Réponses à la sclérose en plaques en 20 questions
Comment pourrait-on définir la sclérose en plaques?
La sclérose en plaques est un dérèglement du système immunitaire qui provoque secondairement des lésions inflammatoires focales dans le système nerveux central (SNC) et une dégénérescence, induite par cette inflammation, de diverses voies nerveuses avec destruction de cellules nerveuses (neurones) et de leurs prolongements (axones). Il s’agit donc d’une "collision" entre les deux systèmes biologiques les plus complexes de l’organisme humain, le système immunitaire d’une part, le SNC d’autre part.
Un dérèglement du système immunitaire
Notre système immunitaire constitue un réseau très complexe de cellules et de protéines. Sa raison d’être est de défendre notre corps contre les agressions extérieures, en particulier, contre les infections bactériennes, virales et parasitaires (immunité antiinfectieuse). Il doit nous défendre aussi contre des cellules cancéreuses qui ne sont plus des cellules normales de notre organisme (immunité anti-tumorale).
Si notre système immunitaire est perturbé pour l’une ou l’autre raison et qu’il enclenche une réaction d’auto-agression contre des organes de notre propre corps, on parle de maladies auto-immunes.
Bien que la cause exacte de la SEP ne soit toujours pas connue, on considère aujourd’hui que la SEP est une maladie auto-immune du SNC, qui détruit la gaine de myéline et/ou les cellules qui la produisent (les oligodendrocytes), et dans certains cas, les fibres nerveuses à l’intérieur de cette gaine. La gaine de myéline est constituée de plusieurs enroulements en spirale d’une membrane en continuité directe avec la membrane de l’oligodendrocyte.
Elle a d’une part une fonction protectrice et isolante, et d’autre part, elle assure la rapidité des connexions électriques.Le système immunitaire comprend 490 milliards de lymphocytes* dont 10 milliards circulent dans le sang, 190 milliards sont localisés dans les ganglions lymphoïdes et 290 milliards "patrouillent" dans les différents organes du corps. Dans des circonstances normales, très peu de lymphocytes sont présents dans le cerveau qui est protégé par une "barrière" ("barrière hémato-encéphalique").
Pour traverser cette barrière, il faut que le lymphocyte soit "activé", ce qui est le cas des lymphocytes présents dans les plaques, les méninges et le liquide céphalo-rachidien (LCR) des patients SEP. On ne sait toujours pas où cette activation anormale et non régulée se déclare: dans les poumons? La muqueuse intestinale? Dans les ganglions du cou?...
Une fraction importante de ces cellules, les lymphocytes T (voir schéma ci-contre), peut reconnaître des structures de la myéline et jouer un rôle-clé dans la naissance du processus inflammatoire qui conduit à la destruction de la myéline. Un autre groupe, les lymphocytes B, fabrique différents anticorps. Certains de ces anticorps peuvent attaquer des structures spécifiques de la myéline et jouer aussi un rôle dans la démyélinisation. Ces anticorps sont déterminants pour le diagnostic lorsqu’ils apparaissent sous forme de "bandes oligoclonales" dans le LCR car ces bandes sont présentes chez 95 % des patients SEP (voir question 5).
Des lymphocytes T auto-immuns (voir schéma ci-contre ) qui ne reconnaissent pas leur propre myéline et, la considèrent comme un corps "étranger" sont aussi présents chez toute personne ne souffrant pas de SEP.
Ils n’occasionnent dans ce cas aucune lésion ni aucun symptôme, car d’autres lymphocytes, les lymphocytes T et B régulateurs, les empêchent de s’activer et de proliférer. Dans la SEP, ce mécanisme est défaillant pour des raisons toujours inconnues et il y a donc une "rupture de tolérance". Il est également possible que les lymphocytes T soient "trompés" par des fragments d’agents infectieux qui ressemblent fort aux protéines de la myéline. Il en résulte une réaction immunitaire "croisée", à la fois contre l’agent infectieux initial et la gaine de myéline, par "mimétisme moléculaire". Ceci n’est toujours qu’une hypothèse.
Une maladie inflammatoire du système nerveux central
Une fois activés, ces lymphocytes T auto-immuns traversent la barrière hémato-encéphalique et pénètrent dans le SNC.
C’est au niveau des petites veines que le flux sanguin est le plus lent et que les lymphocytes s’accrochent à leur paroi puis passent à l’intérieur du tissu nerveux.
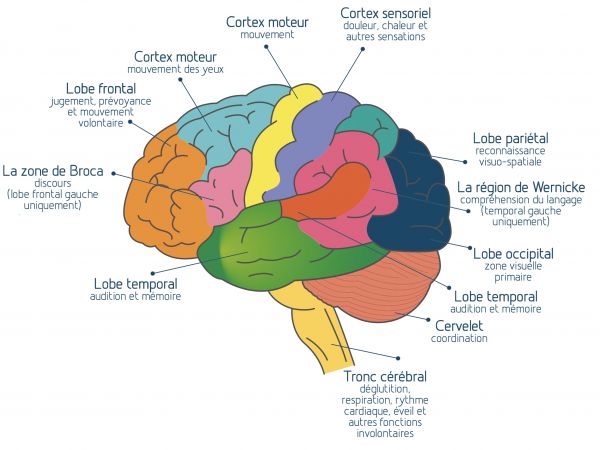
L’Imagerie par Résonnance Magnétique (IRM) peut parfois montrer cette veine centrale au milieu d’une plaque. Tout le SNC est concerné: les méninges, les neurones du cortex cérébral et les neurones des noyaux profonds (thalamus et noyaux gris centraux), la substance blanche qui contient la majorité des fibres nerveuses myélinisées, le cervelet, le tronc cérébral, la moelle épinière, les nerfs optiques.
Lorsque la cellule T activée reconnaît sa cible dans le cerveau (voir schéma p. 6), elle libère des molécules appelées cytokines, qui augmentent la réaction inflammatoire et provoquent l’entrée d’autres lymphocytes dans le cerveau. Les cytokines les mieux connues sont l’interféron gamma et l’interleukine 17.
D’autres cytokines stimulent des enzymes qui occasionnent la destruction de la gaine de myéline. Les mêmes phénomènes peuvent survenir avec les lymphocytes B auto-immuns, qui sont capables d’activer les lymphocytes T auto immuns, ceux-ci provoquant en retour la prolifération de ces lymphocytes B. Ce processus d’escalade peut être ralenti ou bloqué par des facteurs inhibiteurs de l’inflammation. Une de ces cytokines inhibitrices est l’interféron béta, qui est un antagoniste de l’interféron gamma, et qui est largement utilisé dans le traitement de la SEP.
L’inflammation est localisée principalement dans la substance blanche du SNC. Celle-ci est constituée des prolongements des cellules nerveuses proprement dites, les neurones, qui composent la substance grise.
On estime le nombre de neurones à 100 milliards et leurs prolongements, qui peuvent être très longs et sont appelés "axones", relient les cellules nerveuses entre elles. Des signaux électriques circulent le long des axones en véhiculant les informations entre les différentes cellules nerveuses.
La gaine de myéline qui entoure chaque axone est la première cible de l'inflammation. Celle-ci entraîne une démyélinisation et la zone démyélinisée devient un espace cicatriciel "sclérosé". Les impulsions électriques les traversent moins rapidement, la vitesse de conduction pouvant être diminuée jusqu’à 90 % de la normale, et c’est ainsi que certains symptômes de la maladie apparaissent et persistent.
Le cortex cérébral qui est essentiellement composé de neurones, contient cependant aussi des fibres nerveuses entourées de myéline, mais moins compactes et nombreuses que dans la substance blanche. Elles peuvent aussi être détruites dans la SEP et il existe donc des plaques "corticales".
Certaines sont directement localisées sous la méninge la plus interne appelée pie-mère. Dans ce dernier cas, on observe des foyers inflammatoires méningés à proximité, contenant de nombreux lymphocytes d’origine sanguine
Une maladie neurodégénérative provoquée par les inflammations focales et à distance des foyers inflammatoires.
On a très longtemps cru que la démyélinisation était le processus le plus important de la maladie et que la destruction des neurones et des axones n’était que tardive dans l’évolution de la maladie.
Aujourd’hui, il est certain que les prolongements nerveux peuvent être sectionnés ("transsectés*") au niveau d’une plaque par l’inflammation aiguë. Il en résulte une dégénérescence en aval de la fibre nerveuse (dégénérescence antérograde appelée wallérienne du nom d’Auguste Waller qui l’a décrite en 1850), mais aussi une dégénérescence rétrograde, en amont, qui peut remonter jusqu’au corps de la cellule nerveuse et provoquer sa nécrose.
Il en résulte une perte de tissu cérébral et même dans la substance blanche "apparemment normale", où aucune plaque n’est présente, il y a une diminution de la densité axonale.
Dans les plaques corticales comme dans la substance grise apparemment normale, on observe une réduction parfois importante du nombre de neurones.
Cette perte neuronale et axonale joue un rôle important au moment de l’augmentation des troubles en phase progressive, et elle est la cause de séquelles neurologiques irréversibles. Elle provoque aussi une diminution excessive du volume cérébral, de 0,5 à 1 % par an, supérieure à la diminution annuelle de 0,2 à 0,4 % observée chez le sujet normal.
Cette atrophie cérébrale est corrélée significativement à l’atrophie de la rétine dont l’épaisseur diminue.
Cette épaisseur peut être mesurée en opthalmologie par la technique OCT ("Optical Coherence Tomography"). Il s’agit donc d’un phénomène très étendu et général.
Outre une atrophie cérébrale globale, la maladie peut provoquer une atrophie focale de certaines structures cérébrales, en particulier le thalamus (important relais des faisceaux nerveux entre la moelle épinière et le cortex et "activateur" du cortex cérébral), le corps calleux (qui contient toutes les fibres nerveuses reliant les deux hémisphères droit et gauche entre eux) et la moelle épinière.
L’atrophie de celle-ci est secondaire à l’atteinte des voies motrices et des voies sensitives qu’elle contient et elle est fortement corrélée au niveau de handicap des patients.
Qu'est-ce qu'une sclérose en plaques rémittente, secondaire progressive, primaire progressive, bénigne?
Quelles sont les différences? Les fréquences? Peut-on les objectiver par une I.R.M.?
Le syndrome radiologiquement isolé
Il s’agit de la découverte fortuite de lésions, très suspectes d’être des plaques de SEP, lors de la réalisation d’une IRM cérébrale pour un tout autre motif, tel que des maux de tête, un traumatisme crânien, une suspicion de tumeur hypophysaire… Ces personnes n’ont jamais eu le moindre symptôme de SEP. Il n’y a pas lieu d’instaurer un traitement particulier mais il est indiqué de suivre l’évolution par des IRM de contrôle. Un tiers des personnes présentant un tel syndrome radiologiquement isolé va en effet développer une SEP clinique dans les 3 années qui suivent.
Le syndrome cliniquement isolé
Il s’agit de personnes développant une première poussée inflammatoire dans le SNC avec une symptomatologie typique de SEP. Il n’y a cependant pas de dissémination des lésions, soit dans l’espace cérébral (une seule lésion est détectable), soit dans le temps (il n’y a pas une lésion ancienne inactive et une lésion nouvelle active). En l’absence de cette double dissémination spatiale et temporelle, on ne peut pas retenir le diagnostic de SEP.
Un traitement immunomodulateur peut être initié en fonction de différents critères cliniques et radiologiques. En cas d’abstention thérapeutique, des contrôles réguliers devront être cependant effectués en particulier par imagerie cérébrale
La SEP avec poussées et rémission, appelée aussi SEP rémittente
Il s’agit de personnes qui ont présenté une première poussée de sclérose en plaques avec en IRM présence de plusieurs lésions, certaines anciennes, d’autres récentes et actives. Dans ce cas, il y a donc double dissémination spatiale et temporelle. Ou bien il s’agit de personnes qui n’ont présenté qu’une seule poussée, mais dont les IRM de contrôle ont montré une ou plusieurs nouvelle(s) lésion(s). Ou bien, il s’agit de personnes qui ont fait au moins deux poussées de la maladie.
C’est la forme majoritaire de SEP (55%), avec des poussées variables en fréquence et en intensité, soit complètement réversibles soit laissant des séquelles persistantes, mais avec absence d’aggravation des symptômes entre deux poussées. Les poussées de SEP apparaissent et s’aggravent en quelques heures ou en quelques jours, mais jamais brutalement. Les symptômes doivent persister plus de 24 heures en l’absence de fièvre.
Ils doivent s’accompagner d’anomalies objectives à l’examen neurologique. On peut cependant retenir le diagnostic d’une poussée de manière rétrospective (diagnostic après coup) si le patient en donne une description fiable et typique. Cette forme de SEP peut être inactive, soit spontanément, soit grâce à un traitement immunomodulateur (statut "NEDA", voir question 16), ou active, si des poussées cliniques surviennent et/ou si l’IRM montre de nouvelles lésions par rapport aux imageries précédentes.
La SEP progressive
Il s’agit d’une aggravation progressive sur plusieurs mois, de déficits neurologiques, soit dès le début de la maladie en l’absence de toute poussée initiale (forme primaire progressive, qui représente 10 à 15 % des cas de SEP), soit après une première phase de poussées et de rémissions (forme secondaire progressive).
À l’heure actuelle, nous ne disposons pas encore de critères spécifiques et précis pour déterminer le moment de la transition d’une forme avec poussées et rémission vers une forme secondairement progressive.
Des études ont cependant montré que si le nombre total de lésions observées en IRM était élevé 5 ans après le début de la maladie, le risque de passer dans une forme secondaire progressive était très important. Cette progression doit être évaluée au moins une fois par an sur base d’une échelle d’invalidité de 0 à 10, appelée EDSS (« Expanded Disability Status Scale ») et doit être différenciée de l’accumulation des déficits résultant des séquelles des poussées précédentes. Dans ces formes progressives, primaires ou secondaires, on distinguera 4 sous-types: - 1° les formes actives avec progression, - 2° les formes actives sans progression, - 3° les formes non actives avec progression, - 4° les formes non actives et sans progression (dans ce cas, il s’agit d’une maladie stabilisée "en plateau" qui est toujours susceptible d’évoluer plus tard).
Le terme "actif" signifie la présence de poussées surajoutées à la progression et/ou des modifications des images en IRM. Le terme "progression" signifie l’aggravation des symptômes et du handicap, mesurée par l’échelle EDSS. Il faut insister sur le fait que la sévérité et l’activité de la maladie peuvent se modifier de manière importante mais imprévisible, tout au long de son évolution. Le terme de SEP "bénigne" est toujours un diagnostic rétrospectif qui ne peut être posé qu’après 20 ou 30 ans d’évolution.
C’est donc à chaque patient, avec son neurologue traitant, de déterminer ensemble, de manière régulière, au minimum une fois par an, l’évolution et les caractéristiques de sa maladie.
Qu'est-ce qu'une forme tardive de SEP
De manière un peu arbitraire, les formes tardives de sclérose en plaques sont celles qui débutent après l’âge de 40 ans.
Les formes tardives peuvent être des SEP rémittentes mais aussi des formes primaires progressives. Dans ce dernier cas, il n’y a pas de prépondérance féminine et les hommes sont autant affectés que les femmes par la maladie.
Il s’agira, le plus souvent, d’une atteinte des membres inférieurs avec perturbation progressive de la marche et limitation du périmètre de marche. Même si elle débute plus tardivement, cette forme primaire progressive a un moins bon pronostic global, vu la perte progressive de l’autonomie à la marche. Il existe aussi des formes progressives cérébelleuses qui provoquent des tremblements et des troubles de l’équilibre de plus en plus importants à tel point que la marche devient impossible sans qu’il y ait pour autant une perte de force dans les membres inférieurs. C’est donc l’instabilité qui domine.
On connaît aussi des formes progressives cognitives, plus rares, où les troubles intellectuels s’aggravent progressivement alors que sur le plan physique, les déficits sont minimes ou même absents.
Qu'est-ce qu'une forme juvénile?
Les formes juvéniles sont celles qui débutent avant l’âge de 18 ans. Les formes juvéniles débutant avant l’âge de 18 ans sont pratiquement toujours des SEP rémittentes et donc jamais des formes primaires progressives. Elles sont caractérisées par une prépondérance féminine et par des poussées souvent plus fréquentes que chez les adultes. Comme ces formes apparaissent à un âge où la maturation cérébrale se poursuit, il y aura plus rapidement une interférence avec les capacités intellectuelles, les mécanismes d’apprentissage, la mémoire, et les résultats scolaires pourront en être affectés.
Il y a actuellement un consensus pour traiter de manière précoce et énergique ces formes juvéniles
L’évolution des formes juvéniles ne sera pas plus rapide que celle des formes adultes, mais comme elles commencent plus tôt, des handicaps significatifs peuvent être observés une dizaine d’années plus précocement. Il y a actuellement un consensus pour traiter de manière précoce et énergique ces formes juvéniles, vu leur répercussion possible sur la maturation cérébrale. Ces formes juvéniles commencent le plus souvent après la puberté, entre 14 et 18 ans, mais certaines peuvent débuter dès l’âge de 10 ans.
Si la SEP touche majoritairement les femmes, les hormones ne joueraient-elles pas un rôle?
De manière générale, les maladies auto-immunes sont plus fréquentes chez la femme que chez l’homme. Il existe certainement des relations entre le système endocrinien et donc la production d’hormones, et le système immunitaire.
Il est bien établi que l’utilisation de la pilule contraceptive n’est pas un facteur de susceptibilité à développer la maladie, ni un facteur d’aggravation de celle-ci.
Par contre, les hormones progestatives, synthétisées à haute dose durant la grossesse, ont un effet protecteur sur les poussées de la maladie.
Celles-ci diminuent en cours de grossesse, de trimestre en trimestre, mais peuvent être plus fréquentes dans les 3 mois qui suivent l’accouchement.
On estime que 20 % des femmes SEP sont susceptibles de faire une poussée durant les 3 mois qui suivent unaccouchement.
D’autres études épidémiologiques ont montré que la grossesse avait un effet plutôt protecteur sur l’évolution de la maladie, que ces grossesses aient eu lieu avant le déclenchement de la maladie ou après celui-ci.
Une grossesse est caractérisée en effet par un état de relative immunosuppression pour tolérer ce petit "étranger" qu’est le foetus. Cet état de tolérance peut donc être positif pour l’évolution de la SEP à court et même à long terme.
Nous savons, par contre, que la prévalence* de la maladie augmente et que cette augmentation se marque surtout chez la femme.
Dans la SEP, les chiffres de prévalence habituellement cités sont de 100/100.000, soit une personne atteinte pour 1000 habitants. Si on tient compte des données épidémiologiques observées dans les départements du Nord de la France qui jouxtent la frontière belge, on atteint régulièrement des chiffres de 120/100.000 soit 1,2 personne/1000 habitants.
L’augmentation du nombre de personnes atteintes de SEP s’observe beaucoup plus chez la femme que chez l’homme.
Il en résulte que "le sex ratio" femme/homme est en augmentation, de 1,8/1 anciennement, à 3/1.
L’incidence de la maladie, c’est-à-dire le nombre de nouveaux cas diagnostiqués par an, est aussi en augmentation, ayant doublé chez la femme entre 1950 et 2009, et augmenté seulement de 24 % chez l’homme durant la même période, selon une étude danoise récemment publiée.
On ne connaît pas les raisons exactes de cette augmentation disproportionnée chez la femme, mais un tabagisme féminin plus important et des grossesses plus tardives y contribuent certainement.
La Belgique comptant 11 millions d’habitants, on peut estimer le nombre de personnes atteintes de SEP dans notre pays à 13.500 environ.
Y-a-t-il des progrès au niveau du diagnostic
Les potentiels évoqués et la ponction lombaire sont-ils systématiques et toujours utiles actuellement?
Les critères de diagnostic de la SEP font l’objet d’une attention particulière des neurologues et ont été revus très régulièrement en fonction des nouvelles technologies à notre disposition.
C’est ainsi que les critères de Schumacher en 1965 avaient été modifiés par Charles Poser en 1983 puis par Ian McDonald en 2001, avec révisions en 2005, 2011 et 2017.
Cette dernière version vient d’être publiée en juin 2018. Tous ces critères reposent cependant sur le même principe, à savoir que pour poser le diagnostic de SEP, il faut que les symptômes et/ou les lésions caractéristiques de la maladie résultent d’une dissémination dans l’espace (du système nerveux central) et dans le temps.
Tous ces critères insistent aussi sur le fait qu’il faut exclure toute autre maladie neurologique qui pourrait mieux expliquer les symptômes du patient, les anomalies observées en IRM et les perturbations du LCR.
En présence d’un syndrome cliniquement isolé (voir question 2) , pour prouver une dissémination spatiale, il faut démontrer qu’il y a au moins une lésion dans deux territoires du SNC, soit en région périventriculaire, soit en zone corticale ou juxta corticale, soit dans la fosse postérieure sous la tente du cervelet (tronc cérébral et cervelet, voir schémas ci-contre), soit dans la moelle épinière. Une lésion dans un nerf optique ne peut pas être prise en considération, car d’autres maladiespeuvent donner les mêmes anomalies du nerf optique.
De même, en présence d’un syndrome cliniquement isolé, pour prouver une dissémination dans le temps, il faut que l’IRM montre à la fois une (ou plusieurs) lésion(s) prenant le produit de contraste, c’est-à-dire au moins une lésion active et inflammatoire, et des lésions plus anciennes ne captant pas ce produit de contraste.
Si l’IRM ne montre pas de lésions captant le produit de contraste, la présence d’une réaction inflammatoire dans le LCR sous forme de bandes oligoclonales* IgG remplace ce critère et est considérée aussi comme une preuve de dissémination dans le temps. La dernière révision des critères de diagnostic redonne donc plus d’importance aux anomalies du LCR. Par ailleurs, si ce LCR contient trop de cellules inflammatoires (> 50/ μL) ou trop de protéines, le diagnostic de SEP est peu probable et une autre maladie doit être recherchée.
Pour diagnostiquer une forme primaire progressive de SEP, il faut déterminer rétrospectivement ou prospectivement la progression d’un handicap sur une période de un an. Il faut aussi la présence de 2 critères supplémentaires parmi les 3 suivants:
- 1° au moins une lésion détectable par l’IRM en région périventriculaire, ou corticale/juxta corticale, ou sous la tente du cervelet;
- 2° au moins deux lésions dans la moelle épinière;
- 3° la présence de bandes oligoclonales spécifiques du LCR.
Depuis l’utilisation généralisée de l’IRM, l’importance des potentiels évoqués a donc nettement diminué dans les critères de diagnostic de la SEP.
La dissémination spatiale est en effet beaucoup mieux démontrée par l’imagerie que par les techniques neurophysiologiques.
Les potentiels évoqués visuels restent cependant intéressants en cas de suspicion de névrite optique.
Les potentiels évoqués seront incontournables dans les études visant à démontrer l’absence de neurodégénérescence par des nouvelles médications
La règle est donc aussi d’exclure d’autres maladies qui pourraient "mimer" la SEP. Il faut se méfier d’une confiance excessive dans l’imagerie cérébrale et éviter à tout prix un faux diagnostic de SEP.
Par exemple, les migraineux présentent régulièrement des petits foyers hyperintenses en IRM qui pourraient être interprétés comme des lésions de SEP. Les migraines peuvent aussi s’accompagner de symptômes visuels ou sensitifs transitoires ce qui peut induire une erreur de diagnostic. Des signaux anormaux sont aussi observés en IRM chez les personnes de plus de 55 – 60 ans, surtout en cas de facteurs de risque vasculaire (hypertension artérielle, diabète, tabagisme, hypercholestérolémie).
Dans ce cas, l’imagerie cérébrale est moins spécifique, même si les lésions de SEP ont des caractéristiques de mieux en mieux reconnues par les radiologues et neurologues expérimentés.
D’autres maladies inflammatoires du SNC peuvent aussi donner le change pour une SEP. Il s’agit surtout de la neuromyélite optique qui touche essentiellement les nerfs optiques et la moelle épinière mais aussi parfois le cerveau, les encéphalites auto-immunes, les encéphalites virales, le neurolupus, la neurosarcoïdose, la neuroborréliose…
Ceci explique que le diagnostic initial peut rester en suspens et ne peut être définitivement retenu ou exclu que sur base de l’évolution clinique (nouvelle poussée) et radiologique (nouvelles lésions en IRM), dans les mois et les années qui suivent.
Quels sont les facteurs génétiques et environnementaux qui augmentent la susceptibilité de déclencher la maladie?
Les facteurs génétiques de susceptibilité.
Les facteurs environnementaux
Le rôle des infections et des vaccinations
La surcharge pondérale et l'obésité
L'exposition aux solvants organiques
Le rôle du stress et des traumatismes
De plus en plus, on dit que les intestins jouent un rôle dans l'immunité. On parle de perméabilité intestinale. Y-a-t-il un lien avec la SEP?
On connaît bien les symptômes principaux de la SEP mais moins bien les symptômes plus discrets ou moins visibles. Quels sont-ils?
Qu'est-ce qu'une douleur neuropathique?
Comment la traiter?
Que faire si la douleur résiste au traitement?
Pourquoi faut-il impérativement combattre la fièvre?
La SEP prédispose-t-elle à certaines autres maladies et si oui, pourquoi?
Quel est le rôle de la vitamine B12?
On parle de possibilité de remyélinisation: qu'en est-il?
Est-ce valable pour toute forme de SEP?
Vu le rôle crucial du système immunitaire dans la SEP, de quelle manière celui-ci est-il impacté par les traitements immunomodulateurs actuels?
| Nom | Mode d’administration | Posologie |
| Interférons bêta | Voie sous cutanée ou
intra-musculaire || Fréquence variable suivant la molécule | |
| Copaxone® | ||
| Aubagio® | ||
| Tecfidera® | ||
| Tysabri® | ||
| Gilenya® | ||
| Lemtrada® | ||
| OcrévusTM | ||
| Mavenclad® |
Quels sont les effets secondaires des nouveaux traitements?
Quels sont les risques et les alternatives éventuelles?
Quels sont les traitements pour les formes progressives de la maladie ?
Qu'est-ce que la thérapie cellulaire? Est-ce prometteur pour l'avenir?
La recherche: quelles sont les perspectives d'avenir?
Qu'est-ce que le registre BELTRIMS?
Quel message les chercheurs et les médecins pourraient-ils transmettre aux personnes atteintes de SEP?
Lexique
Lésion focale :
Lésion bien localisée avec des limites nettes. C’est le cas pour la majorité des plaques de SEP