Réponses à la sclérose en plaques en 20 questions
Préambule
Ce supplément du journal "La Clef" est basé sur 20 questions relatives aux aspects médicaux de la SEP, provenant de membres de la Ligue souhaitant avoir une information plus détaillée sur certains aspects de la maladie.
J’ai tenté de répondre à ces 20 questions, sans en modifier la formulation, le plus clairement possible.
Bien évidemment, il n’y a pas de réponse définitive à certaines de ces questions compte tenu de ce que nous ignorons encore de la maladie. Je me suis efforcé d’utiliser les mots les plus justes dans mes réponses, car, comme disait Albert Camus: "Mal nommer un objet, c’est ajouter au malheur de ce monde".
Professeur Christian SINDIC Président de la Fondation Charcot
Comment pourrait-on définir la sclérose en plaques?
La sclérose en plaques est un dérèglement du système immunitaire qui provoque secondairement des lésions inflammatoires focales dans le système nerveux central (SNC) et une dégénérescence, induite par cette inflammation, de diverses voies nerveuses avec destruction de cellules nerveuses (neurones) et de leurs prolongements (axones). Il s’agit donc d’une "collision" entre les deux systèmes biologiques les plus complexes de l’organisme humain, le système immunitaire d’une part, le SNC d’autre part.
Un dérèglement du système immunitaire
Notre système immunitaire constitue un réseau très complexe de cellules et de protéines. Sa raison d’être est de défendre notre corps contre les agressions extérieures, en particulier, contre les infections bactériennes, virales et parasitaires (immunité antiinfectieuse). Il doit nous défendre aussi contre des cellules cancéreuses qui ne sont plus des cellules normales de notre organisme (immunité anti-tumorale).
Si notre système immunitaire est perturbé pour l’une ou l’autre raison et qu’il enclenche une réaction d’auto-agression contre des organes de notre propre corps, on parle de maladies auto-immunes.
Bien que la cause exacte de la SEP ne soit toujours pas connue, on considère aujourd’hui que la SEP est une maladie auto-immune du SNC, qui détruit la gaine de myéline et/ou les cellules qui la produisent (les oligodendrocytes), et dans certains cas, les fibres nerveuses à l’intérieur de cette gaine. La gaine de myéline est constituée de plusieurs enroulements en spirale d’une membrane en continuité directe avec la membrane de l’oligodendrocyte.
Elle a d’une part une fonction protectrice et isolante, et d’autre part, elle assure la rapidité des connexions électriques.Le système immunitaire comprend 490 milliards de lymphocytes* dont 10 milliards circulent dans le sang, 190 milliards sont localisés dans les ganglions lymphoïdes et 290 milliards "patrouillent" dans les différents organes du corps. Dans des circonstances normales, très peu de lymphocytes sont présents dans le cerveau qui est protégé par une "barrière" ("barrière hémato-encéphalique").
Pour traverser cette barrière, il faut que le lymphocyte soit "activé", ce qui est le cas des lymphocytes présents dans les plaques, les méninges et le liquide céphalo-rachidien (LCR) des patients SEP. On ne sait toujours pas où cette activation anormale et non régulée se déclare: dans les poumons? La muqueuse intestinale? Dans les ganglions du cou?...
Une fraction importante de ces cellules, les lymphocytes T (voir schéma ci-contre), peut reconnaître des structures de la myéline et jouer un rôle-clé dans la naissance du processus inflammatoire qui conduit à la destruction de la myéline. Un autre groupe, les lymphocytes B, fabrique différents anticorps. Certains de ces anticorps peuvent attaquer des structures spécifiques de la myéline et jouer aussi un rôle dans la démyélinisation. Ces anticorps sont déterminants pour le diagnostic lorsqu’ils apparaissent sous forme de "bandes oligoclonales" dans le LCR car ces bandes sont présentes chez 95 % des patients SEP (voir question 5).
Des lymphocytes T auto-immuns (voir schéma ci-contre ) qui ne reconnaissent pas leur propre myéline et, la considèrent comme un corps "étranger" sont aussi présents chez toute personne ne souffrant pas de SEP.
Ils n’occasionnent dans ce cas aucune lésion ni aucun symptôme, car d’autres lymphocytes, les lymphocytes T et B régulateurs, les empêchent de s’activer et de proliférer. Dans la SEP, ce mécanisme est défaillant pour des raisons toujours inconnues et il y a donc une "rupture de tolérance". Il est également possible que les lymphocytes T soient "trompés" par des fragments d’agents infectieux qui ressemblent fort aux protéines de la myéline. Il en résulte une réaction immunitaire "croisée", à la fois contre l’agent infectieux initial et la gaine de myéline, par "mimétisme moléculaire". Ceci n’est toujours qu’une hypothèse.
Une maladie inflammatoire du système nerveux central
Une fois activés, ces lymphocytes T auto-immuns traversent la barrière hémato-encéphalique et pénètrent dans le SNC.
C’est au niveau des petites veines que le flux sanguin est le plus lent et que les lymphocytes s’accrochent à leur paroi puis passent à l’intérieur du tissu nerveux.
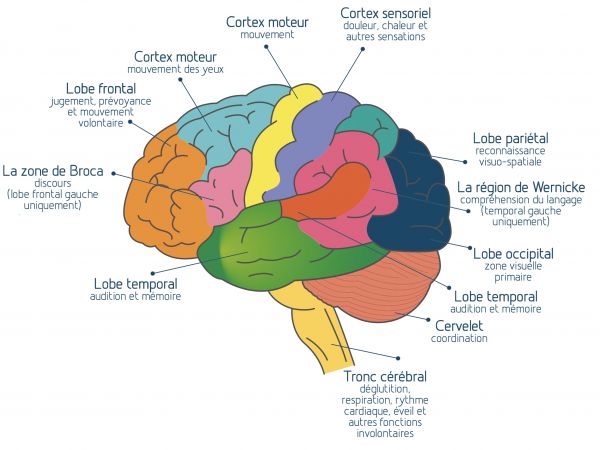
L’Imagerie par Résonnance Magnétique (IRM) peut parfois montrer cette veine centrale au milieu d’une plaque. Tout le SNC est concerné: les méninges, les neurones du cortex cérébral et les neurones des noyaux profonds (thalamus et noyaux gris centraux), la substance blanche qui contient la majorité des fibres nerveuses myélinisées, le cervelet, le tronc cérébral, la moelle épinière, les nerfs optiques.
Lorsque la cellule T activée reconnaît sa cible dans le cerveau (voir schéma p. 6), elle libère des molécules appelées cytokines, qui augmentent la réaction inflammatoire et provoquent l’entrée d’autres lymphocytes dans le cerveau. Les cytokines les mieux connues sont l’interféron gamma et l’interleukine 17.
D’autres cytokines stimulent des enzymes qui occasionnent la destruction de la gaine de myéline. Les mêmes phénomènes peuvent survenir avec les lymphocytes B auto-immuns, qui sont capables d’activer les lymphocytes T auto immuns, ceux-ci provoquant en retour la prolifération de ces lymphocytes B. Ce processus d’escalade peut être ralenti ou bloqué par des facteurs inhibiteurs de l’inflammation. Une de ces cytokines inhibitrices est l’interféron béta, qui est un antagoniste de l’interféron gamma, et qui est largement utilisé dans le traitement de la SEP.
L’inflammation est localisée principalement dans la substance blanche du SNC. Celle-ci est constituée des prolongements des cellules nerveuses proprement dites, les neurones, qui composent la substance grise.
On estime le nombre de neurones à 100 milliards et leurs prolongements, qui peuvent être très longs et sont appelés "axones", relient les cellules nerveuses entre elles. Des signaux électriques circulent le long des axones en véhiculant les informations entre les différentes cellules nerveuses.
La gaine de myéline qui entoure chaque axone est la première cible de l'inflammation. Celle-ci entraîne une démyélinisation et la zone démyélinisée devient un espace cicatriciel "sclérosé". Les impulsions électriques les traversent moins rapidement, la vitesse de conduction pouvant être diminuée jusqu’à 90 % de la normale, et c’est ainsi que certains symptômes de la maladie apparaissent et persistent.
Le cortex cérébral qui est essentiellement composé de neurones, contient cependant aussi des fibres nerveuses entourées de myéline, mais moins compactes et nombreuses que dans la substance blanche. Elles peuvent aussi être détruites dans la SEP et il existe donc des plaques "corticales".
Certaines sont directement localisées sous la méninge la plus interne appelée pie-mère. Dans ce dernier cas, on observe des foyers inflammatoires méningés à proximité, contenant de nombreux lymphocytes d’origine sanguine
Une maladie neurodégénérative provoquée par les inflammations focales et à distance des foyers inflammatoires.
On a très longtemps cru que la démyélinisation était le processus le plus important de la maladie et que la destruction des neurones et des axones n’était que tardive dans l’évolution de la maladie.
Aujourd’hui, il est certain que les prolongements nerveux peuvent être sectionnés ("transsectés*") au niveau d’une plaque par l’inflammation aiguë. Il en résulte une dégénérescence en aval de la fibre nerveuse (dégénérescence antérograde appelée wallérienne du nom d’Auguste Waller qui l’a décrite en 1850), mais aussi une dégénérescence rétrograde, en amont, qui peut remonter jusqu’au corps de la cellule nerveuse et provoquer sa nécrose.
Il en résulte une perte de tissu cérébral et même dans la substance blanche "apparemment normale", où aucune plaque n’est présente, il y a une diminution de la densité axonale.
Dans les plaques corticales comme dans la substance grise apparemment normale, on observe une réduction parfois importante du nombre de neurones.
Cette perte neuronale et axonale joue un rôle important au moment de l’augmentation des troubles en phase progressive, et elle est la cause de séquelles neurologiques irréversibles. Elle provoque aussi une diminution excessive du volume cérébral, de 0,5 à 1 % par an, supérieure à la diminution annuelle de 0,2 à 0,4 % observée chez le sujet normal.
Cette atrophie cérébrale est corrélée significativement à l’atrophie de la rétine dont l’épaisseur diminue.
Cette épaisseur peut être mesurée en opthalmologie par la technique OCT ("Optical Coherence Tomography"). Il s’agit donc d’un phénomène très étendu et général.
Outre une atrophie cérébrale globale, la maladie peut provoquer une atrophie focale de certaines structures cérébrales, en particulier le thalamus (important relais des faisceaux nerveux entre la moelle épinière et le cortex et "activateur" du cortex cérébral), le corps calleux (qui contient toutes les fibres nerveuses reliant les deux hémisphères droit et gauche entre eux) et la moelle épinière.
L’atrophie de celle-ci est secondaire à l’atteinte des voies motrices et des voies sensitives qu’elle contient et elle est fortement corrélée au niveau de handicap des patients.
Qu'est-ce qu'une sclérose en plaques rémittente, secondaire progressive, primaire progressive, bénigne?
Quelles sont les différences? Les fréquences? Peut-on les objectiver par une I.R.M.?
Le syndrome radiologiquement isolé
Il s’agit de la découverte fortuite de lésions, très suspectes d’être des plaques de SEP, lors de la réalisation d’une IRM cérébrale pour un tout autre motif, tel que des maux de tête, un traumatisme crânien, une suspicion de tumeur hypophysaire… Ces personnes n’ont jamais eu le moindre symptôme de SEP. Il n’y a pas lieu d’instaurer un traitement particulier mais il est indiqué de suivre l’évolution par des IRM de contrôle. Un tiers des personnes présentant un tel syndrome radiologiquement isolé va en effet développer une SEP clinique dans les 3 années qui suivent.
Le syndrome cliniquement isolé
Il s’agit de personnes développant une première poussée inflammatoire dans le SNC avec une symptomatologie typique de SEP. Il n’y a cependant pas de dissémination des lésions, soit dans l’espace cérébral (une seule lésion est détectable), soit dans le temps (il n’y a pas une lésion ancienne inactive et une lésion nouvelle active). En l’absence de cette double dissémination spatiale et temporelle, on ne peut pas retenir le diagnostic de SEP.
Un traitement immunomodulateur peut être initié en fonction de différents critères cliniques et radiologiques. En cas d’abstention thérapeutique, des contrôles réguliers devront être cependant effectués en particulier par imagerie cérébrale
La SEP avec poussées et rémission, appelée aussi SEP rémittente
Il s’agit de personnes qui ont présenté une première poussée de sclérose en plaques avec en IRM présence de plusieurs lésions, certaines anciennes, d’autres récentes et actives. Dans ce cas, il y a donc double dissémination spatiale et temporelle. Ou bien il s’agit de personnes qui n’ont présenté qu’une seule poussée, mais dont les IRM de contrôle ont montré une ou plusieurs nouvelle(s) lésion(s). Ou bien, il s’agit de personnes qui ont fait au moins deux poussées de la maladie.
C’est la forme majoritaire de SEP (55%), avec des poussées variables en fréquence et en intensité, soit complètement réversibles soit laissant des séquelles persistantes, mais avec absence d’aggravation des symptômes entre deux poussées. Les poussées de SEP apparaissent et s’aggravent en quelques heures ou en quelques jours, mais jamais brutalement. Les symptômes doivent persister plus de 24 heures en l’absence de fièvre.
Ils doivent s’accompagner d’anomalies objectives à l’examen neurologique. On peut cependant retenir le diagnostic d’une poussée de manière rétrospective (diagnostic après coup) si le patient en donne une description fiable et typique. Cette forme de SEP peut être inactive, soit spontanément, soit grâce à un traitement immunomodulateur (statut "NEDA", voir question 16), ou active, si des poussées cliniques surviennent et/ou si l’IRM montre de nouvelles lésions par rapport aux imageries précédentes.
La SEP progressive
Il s’agit d’une aggravation progressive sur plusieurs mois, de déficits neurologiques, soit dès le début de la maladie en l’absence de toute poussée initiale (forme primaire progressive, qui représente 10 à 15 % des cas de SEP), soit après une première phase de poussées et de rémissions (forme secondaire progressive).
À l’heure actuelle, nous ne disposons pas encore de critères spécifiques et précis pour déterminer le moment de la transition d’une forme avec poussées et rémission vers une forme secondairement progressive.
Des études ont cependant montré que si le nombre total de lésions observées en IRM était élevé 5 ans après le début de la maladie, le risque de passer dans une forme secondaire progressive était très important. Cette progression doit être évaluée au moins une fois par an sur base d’une échelle d’invalidité de 0 à 10, appelée EDSS (« Expanded Disability Status Scale ») et doit être différenciée de l’accumulation des déficits résultant des séquelles des poussées précédentes. Dans ces formes progressives, primaires ou secondaires, on distinguera 4 sous-types: - 1° les formes actives avec progression, - 2° les formes actives sans progression, - 3° les formes non actives avec progression, - 4° les formes non actives et sans progression (dans ce cas, il s’agit d’une maladie stabilisée "en plateau" qui est toujours susceptible d’évoluer plus tard).
Le terme "actif" signifie la présence de poussées surajoutées à la progression et/ou des modifications des images en IRM. Le terme "progression" signifie l’aggravation des symptômes et du handicap, mesurée par l’échelle EDSS. Il faut insister sur le fait que la sévérité et l’activité de la maladie peuvent se modifier de manière importante mais imprévisible, tout au long de son évolution. Le terme de SEP "bénigne" est toujours un diagnostic rétrospectif qui ne peut être posé qu’après 20 ou 30 ans d’évolution.
C’est donc à chaque patient, avec son neurologue traitant, de déterminer ensemble, de manière régulière, au minimum une fois par an, l’évolution et les caractéristiques de sa maladie.
Qu'est-ce qu'une forme tardive de SEP
De manière un peu arbitraire, les formes tardives de sclérose en plaques sont celles qui débutent après l’âge de 40 ans.
Les formes tardives peuvent être des SEP rémittentes mais aussi des formes primaires progressives. Dans ce dernier cas, il n’y a pas de prépondérance féminine et les hommes sont autant affectés que les femmes par la maladie.
Il s’agira, le plus souvent, d’une atteinte des membres inférieurs avec perturbation progressive de la marche et limitation du périmètre de marche. Même si elle débute plus tardivement, cette forme primaire progressive a un moins bon pronostic global, vu la perte progressive de l’autonomie à la marche. Il existe aussi des formes progressives cérébelleuses qui provoquent des tremblements et des troubles de l’équilibre de plus en plus importants à tel point que la marche devient impossible sans qu’il y ait pour autant une perte de force dans les membres inférieurs. C’est donc l’instabilité qui domine.
On connaît aussi des formes progressives cognitives, plus rares, où les troubles intellectuels s’aggravent progressivement alors que sur le plan physique, les déficits sont minimes ou même absents.
Qu'est-ce qu'une forme juvénile?
Les formes juvéniles sont celles qui débutent avant l’âge de 18 ans. Les formes juvéniles débutant avant l’âge de 18 ans sont pratiquement toujours des SEP rémittentes et donc jamais des formes primaires progressives. Elles sont caractérisées par une prépondérance féminine et par des poussées souvent plus fréquentes que chez les adultes. Comme ces formes apparaissent à un âge où la maturation cérébrale se poursuit, il y aura plus rapidement une interférence avec les capacités intellectuelles, les mécanismes d’apprentissage, la mémoire, et les résultats scolaires pourront en être affectés.
Il y a actuellement un consensus pour traiter de manière précoce et énergique ces formes juvéniles
L’évolution des formes juvéniles ne sera pas plus rapide que celle des formes adultes, mais comme elles commencent plus tôt, des handicaps significatifs peuvent être observés une dizaine d’années plus précocement. Il y a actuellement un consensus pour traiter de manière précoce et énergique ces formes juvéniles, vu leur répercussion possible sur la maturation cérébrale. Ces formes juvéniles commencent le plus souvent après la puberté, entre 14 et 18 ans, mais certaines peuvent débuter dès l’âge de 10 ans.
Si la SEP touche majoritairement les femmes, les hormones ne joueraient-elles pas un rôle?
De manière générale, les maladies auto-immunes sont plus fréquentes chez la femme que chez l’homme. Il existe certainement des relations entre le système endocrinien et donc la production d’hormones, et le système immunitaire.
Il est bien établi que l’utilisation de la pilule contraceptive n’est pas un facteur de susceptibilité à développer la maladie, ni un facteur d’aggravation de celle-ci.
Par contre, les hormones progestatives, synthétisées à haute dose durant la grossesse, ont un effet protecteur sur les poussées de la maladie.
Celles-ci diminuent en cours de grossesse, de trimestre en trimestre, mais peuvent être plus fréquentes dans les 3 mois qui suivent l’accouchement.
On estime que 20 % des femmes SEP sont susceptibles de faire une poussée durant les 3 mois qui suivent unaccouchement.
D’autres études épidémiologiques ont montré que la grossesse avait un effet plutôt protecteur sur l’évolution de la maladie, que ces grossesses aient eu lieu avant le déclenchement de la maladie ou après celui-ci.
Une grossesse est caractérisée en effet par un état de relative immunosuppression pour tolérer ce petit "étranger" qu’est le foetus. Cet état de tolérance peut donc être positif pour l’évolution de la SEP à court et même à long terme.
Nous savons, par contre, que la prévalence* de la maladie augmente et que cette augmentation se marque surtout chez la femme.
Dans la SEP, les chiffres de prévalence habituellement cités sont de 100/100.000, soit une personne atteinte pour 1000 habitants. Si on tient compte des données épidémiologiques observées dans les départements du Nord de la France qui jouxtent la frontière belge, on atteint régulièrement des chiffres de 120/100.000 soit 1,2 personne/1000 habitants.
L’augmentation du nombre de personnes atteintes de SEP s’observe beaucoup plus chez la femme que chez l’homme.
Il en résulte que "le sex ratio" femme/homme est en augmentation, de 1,8/1 anciennement, à 3/1.
L’incidence de la maladie, c’est-à-dire le nombre de nouveaux cas diagnostiqués par an, est aussi en augmentation, ayant doublé chez la femme entre 1950 et 2009, et augmenté seulement de 24 % chez l’homme durant la même période, selon une étude danoise récemment publiée.
On ne connaît pas les raisons exactes de cette augmentation disproportionnée chez la femme, mais un tabagisme féminin plus important et des grossesses plus tardives y contribuent certainement.
La Belgique comptant 11 millions d’habitants, on peut estimer le nombre de personnes atteintes de SEP dans notre pays à 13.500 environ.
Y-a-t-il des progrès au niveau du diagnostic
Les potentiels évoqués et la ponction lombaire sont-ils systématiques et toujours utiles actuellement?
Les critères de diagnostic de la SEP font l’objet d’une attention particulière des neurologues et ont été revus très régulièrement en fonction des nouvelles technologies à notre disposition.
C’est ainsi que les critères de Schumacher en 1965 avaient été modifiés par Charles Poser en 1983 puis par Ian McDonald en 2001, avec révisions en 2005, 2011 et 2017.
Cette dernière version vient d’être publiée en juin 2018. Tous ces critères reposent cependant sur le même principe, à savoir que pour poser le diagnostic de SEP, il faut que les symptômes et/ou les lésions caractéristiques de la maladie résultent d’une dissémination dans l’espace (du système nerveux central) et dans le temps.
Tous ces critères insistent aussi sur le fait qu’il faut exclure toute autre maladie neurologique qui pourrait mieux expliquer les symptômes du patient, les anomalies observées en IRM et les perturbations du LCR.
En présence d’un syndrome cliniquement isolé (voir questio2 ,) pour prouver une dissémination spatiale, il faut démontrer qu’il y a au moins une lésion dans deux territoires du SNC, soit en région périventriculaire, soit en zone corticale ou juxta corticale, soit dans la fosse postérieure sous la tente du cervelet (tronc cérébral et cervelet, voir schémas ci-contre), soit dans la moelle épinière. Une lésion dans un nerf optique ne peut pas être prise en considération, car d’autres maladiespeuvent donner les mêmes anomalies du nerf optique.
De même, en présence d’un syndrome cliniquement isolé, pour prouver une dissémination dans le temps, il faut que l’IRM montre à la fois une (ou plusieurs) lésion(s) prenant le produit de contraste, c’est-à-dire au moins une lésion active et inflammatoire, et des lésions plus anciennes ne captant pas ce produit de contraste.
Si l’IRM ne montre pas de lésions captant le produit de contraste, la présence d’une réaction inflammatoire dans le LCR sous forme de bandes oligoclonales* IgG remplace ce critère et est considérée aussi comme une preuve de dissémination dans le temps. La dernière révision des critères de diagnostic redonne donc plus d’importance aux anomalies du LCR. Par ailleurs, si ce LCR contient trop de cellules inflammatoires (> 50/ μL) ou trop de protéines, le diagnostic de SEP est peu probable et une autre maladie doit être recherchée.
Pour diagnostiquer une forme primaire progressive de SEP, il faut déterminer rétrospectivement ou prospectivement la progression d’un handicap sur une période de un an. Il faut aussi la présence de 2 critères supplémentaires parmi les 3 suivants:
- 1° au moins une lésion détectable par l’IRM en région périventriculaire, ou corticale/juxta corticale, ou sous la tente du cervelet;
- 2° au moins deux lésions dans la moelle épinière;
- 3° la présence de bandes oligoclonales spécifiques du LCR.
Depuis l’utilisation généralisée de l’IRM, l’importance des potentiels évoqués a donc nettement diminué dans les critères de diagnostic de la SEP.
La dissémination spatiale est en effet beaucoup mieux démontrée par l’imagerie que par les techniques neurophysiologiques.
Les potentiels évoqués visuels restent cependant intéressants en cas de suspicion de névrite optique.
Les potentiels évoqués seront incontournables dans les études visant à démontrer l’absence de neurodégénérescence par des nouvelles médications
La règle est donc aussi d’exclure d’autres maladies qui pourraient "mimer" la SEP. Il faut se méfier d’une confiance excessive dans l’imagerie cérébrale et éviter à tout prix un faux diagnostic de SEP.
Par exemple, les migraineux présentent régulièrement des petits foyers hyperintenses en IRM qui pourraient être interprétés comme des lésions de SEP. Les migraines peuvent aussi s’accompagner de symptômes visuels ou sensitifs transitoires ce qui peut induire une erreur de diagnostic. Des signaux anormaux sont aussi observés en IRM chez les personnes de plus de 55 – 60 ans, surtout en cas de facteurs de risque vasculaire (hypertension artérielle, diabète, tabagisme, hypercholestérolémie).
Dans ce cas, l’imagerie cérébrale est moins spécifique, même si les lésions de SEP ont des caractéristiques de mieux en mieux reconnues par les radiologues et neurologues expérimentés.
D’autres maladies inflammatoires du SNC peuvent aussi donner le change pour une SEP. Il s’agit surtout de la neuromyélite optique qui touche essentiellement les nerfs optiques et la moelle épinière mais aussi parfois le cerveau, les encéphalites auto-immunes, les encéphalites virales, le neurolupus, la neurosarcoïdose, la neuroborréliose…
Ceci explique que le diagnostic initial peut rester en suspens et ne peut être définitivement retenu ou exclu que sur base de l’évolution clinique (nouvelle poussée) et radiologique (nouvelles lésions en IRM), dans les mois et les années qui suivent.
Quels sont les facteurs génétiques et environnementaux qui augmentent la susceptibilité de déclencher la maladie?
Les causes de la SEP ne sont pas encore connues. Il est probable que la maladie ne se développe que lorsque plusieurs conditions sont réunies simultanément. Il existe des facteurs génétiques de susceptibilité et des facteurs provenant de l’environnement, qui interagissent avec les facteurs génétiques.
Les facteurs génétiques de susceptibilité.
Grâce à l’étude du génome humain* dans sa totalité, on a pu remarquer que certains gènes* (fragments de chromosome) ou certaines variantes normales de ces gènes ("allèles"), sont sur-représentés chez les patients SEP par rapport à une population contrôle. Le gène le plus sur-représenté fait partie du système majeur d’histocompatibilité qui permet aux lymphocytes de coopérer entre eux et qui est à l’origine du rejet des greffes lorsqu’ il y a discordance entre le greffon et l’hôte.
Le fait d’être porteur du gène HLA-DRB1*15* augmente le risque relatif de développer une SEP par un facteur 3.
Dans la population caucasienne, ce gène est présent chez environ 65 % des patients atteints de SEP, et seulement chez 30 % de la population normale. Il n’est donc ni une condition nécessaire, ni une condition suffisante pour développer une SEP. Plus de 200 autres gènes de susceptibilité ont été détectés avec des risques relatifs assez faibles, inférieurs à 1,3. Il est important de noter que ces gènes sont dans leur immense majorité en relation avec le système immunitaire, ce qui est une preuve indirecte du rôle primordial de ce système dans les mécanismes de la maladie.
Il faut aussi noter que certains de ces gènes de susceptibilité sont communs avec d’autres maladies inflammatoires spécifiques d’organes, telles que la polyarthrite rhumatoïde, le lupus érythémateux disséminé, la maladie de Crohn, le psoriasis (voir définitions p. 31) et le diabète de l’enfant . Certains patients sont d’ailleurs porteurs d’une SEP et d’une autre de ces maladies, ou bien ces maladies sont présentes dans la famille proche du patient SEP.
Pour ajouter à la complexité du système, il a été montré aussi que certains gènes du système majeur d’histocompatibilité* (par exemple, HLA-A*02) étaient sous-représentés chez les personnes atteintes de SEP et que leur présence avait donc un rôle protecteur vis-à-vis de la maladie.
Si l’on ne peut pas, à proprement parler, dire que la SEP est une maladie héréditaire, 10 % des patients SEP comptent un autre membre de leur famille également atteint.
Le risque individuel est donc plus élevé si un des deux parents, ou un frère ou une sœur, est touché par cette maladie.
Par rapport au risque de 0,12 % pour l’ensemble de la population belge, les frères et sœurs d’un patient SEP ont 3 à 4 % de risque de développer eux-mêmes la maladie. Pour chacun des enfants d’un patient SEP, ce risque est de 2,5 %. Si un jumeau homozygote("vrais jumeaux") souffre d’une SEP, son jumeau aun risque de 14 à 25 % d’en souffrir aussi, alors que pour les "faux" jumeaux, le risque est le même qu’entre frères et sœurs.
La concordance chez les vrais jumeaux est plus élevée dans les régions où la maladie est plus fréquente, plus faible dans les régions où elle est plus rare. Cette étude sur les jumeaux prouve qu’il y a en effet un facteur héréditaire dans la SEP mais confirme par ailleurs le rôle important de l’environnement dans l’origine de la maladie.
Si la SEP était une maladie purement génétique, le taux de concordance chez les vrais jumeaux serait de 100%.
Les facteurs environnementaux
La vitamine D
Des études épidémiologiques ont montré aussi bien en Tasmanie qu’en Norvège que les enfants et adolescents ayant des activités physiques à l’extérieur ont moins de risque de développer la SEP à l’âge adulte. L’exposition au soleil entraîne, grâce à l'effet des rayons UV sur la peau, une synthèse plus importante de vitamine D et un taux plus élevé de vitamine D dans le sang.
Cette dernière est très peu présente dans notre alimentation. De nombreuses études ont montré une corrélation entre un taux de vitamine D insuffisant ou même carencé et un risque accru de développer la maladie. Grâce aux registres scandinaves des personnes atteintes de SEP, on a pu montrer aussi que des nouveaux-nés ayant un taux faible de vitamine D présentaient un risque deux fois plus important de développer une SEP à l’âge adulte par rapport à ceux ayant un taux normal.
De même, une étude finlandaise portant sur une cohorte maternelle a montré qu’une carence en vitamine D durant le premier trimestre de la grossesse avait comme conséquence, le doublement du risque relatif de développer une SEP chez les enfants à l’âge adulte par rapport aux femmes enceintes non carencées.
La conclusion pratique est dès lors qu’il faut éviter chez toute femme enceinte et chez les enfants de patients atteints de SEP une insuffisance ou une carence en vitamine D.
Des études françaises ont porté sur la comparaison entre la prévalence de la maladie et l’irradiation solaire moyenne dans les différentes régions de France. La prévalence de la maladie est plus élevée dans le Nord et dans l’Est de la France (100 à 120 patients/100.000 habitants) que sur la façade atlantique ou sur le pourtour méditerranéen (50/100.000).
Cette prévalence est corrélée significativement avec les taux moyens de vitamine D chez les habitants de ces régions et avec l’irradiation solaire moyenne et le taux d’ensoleillement relevés par les statistiques météorologiques.
Le rôle de l’ensoleillement et secondairement du taux de vitamine D peut donc expliquer en partie le gradient Nord-Sud de la prévalence de la maladie observée dans l’hémisphère nord et le gradient Sud- Nord observé dans l’hémisphère sud.
La vitamine D a de nombreuses fonctions et ne joue pas uniquement un rôle important dans le métabolisme du calcium. Elle a aussi un rôle immunorégulateur comme on a pu le montrer dans l’encéphalite auto-immune expérimentale. La question de savoir s’il faut supplémenter en vitamine D les personnes déjà atteintes de SEP reste ouverte mais le principe de précaution voudrait qu’à tout le moins, les patients SEP ne soient pas en déficience ou en carence en vitamine D.
Le tabagisme
Le tabagisme actif chez l’adolescent et le jeune adulte est un facteur de risque de développer une SEP, ce risque étant multiplié par un facteur de 1,4 à 2,0 selon les études. La durée de consommation de tabac et son importance en nombre de cigarettes fumées par jour, augmentent le risque.
Le tabagisme passif est aussi un facteur de risque de l’ordre de 1,3.
Dans une étude suédoise utilisant le registre national des patients atteints de SEP, on a pu montrer une sur-représentation des fumeurs chez les patients SEP par rapport au groupe contrôle, de l’ordre de 20%.
Cette sur-représentation atteint 40 % chez les patients HLA-DRB1*15 positifs et qui ne possèdent pas le gène protecteur HLA-A*02. Ceci démontre une interaction entre les facteurs génétiques et les facteurs d’environnement. La lutte contre le tabagisme des jeunes est un facteur important de prévention de la maladie.
Chez les patients SEP qui continuent de fumer, on a pu montrer qu’une deuxième poussée survenait plus rapidement après le premier épisode que chez les non-fumeurs, que le nombre total de lésions en IRM était en moyenne plus élevé, et que le passage vers la forme secondaire progressive se faisait environ 10 ans plus tôt que chez les non-fumeurs.
L’arrêt du tabagisme, lors du diagnostic, est donc le premier traitement "neuroprotecteur" dans la SEP.
Le rôle des infections et des vaccinations
Certaines infections peuvent déclencher des symptômes proches de ceux de la SEP.
Un virus ou un parasite "neurotrope"* peut infecter directement le cerveau: il s’agit d’une encéphalite primaire, par exemple provoquée par le virus de l’herpès ou par Borrélia dans la maladie de Lyme.
Dans de très rares cas, des symptômes apparaissent sans que l’agent infectieux soit présent dans le cerveau, parce que le système immunitaire réagit anormalement à une infection, ce qui provoque une maladie auto-immune par laquelle le corps détruit ses propres tissus.
Il s’agit toujours d’un épisode unique qui peut être observé à tout âge ("encéphalomyélite aiguë démyélinisante post-infectieuse").
Jusqu’à présent, il n’y aucune preuve que certains virus particuliers soient capables de déclencher une maladie chronique comme la SEP.
Cependant, quasiment 100% des patients atteints de SEP sont porteurs d’anticorps contre le virus Epstein-Barr, le virus responsable de la mononucléose infectieuse, mais ceci est vrai aussi chez 95 % de la population normale.
Dans la grande majorité des cas, l’infection par ce virus passe inaperçue.
Les personnes qui développent des symptômes cliniques de mononucléose (angine, ganglions hypertrophiés et douloureux, fièvre…) ont un risque 3 fois plus important de développer une SEP plus tard.
La manière dont le système immunitaire réagit à ce virus pourrait indiquer qu’il est prédisposé à un dérèglement conduisant à l’apparition d’une SEP.
La fièvre qui accompagne une maladie infectieuse, peut provoquer une augmentation des troubles préexistants chez une personne atteinte de SEP.
Par définition, il ne s’agit pas d’une poussée, mais de l’aggravation d’un bloc de conduction nerveuse au niveau des plaques démyélinisées.
Par contre, le risque de poussée est 3 à 5 fois plus important chez un patient SEP présentant une infection virale, surtout des voies respiratoires supérieures, dans les 6 à 8 semaines entourant l’épisode infectieux.
On interprète cette observation par le fait que l’ensemble du système immunitaire est réactivé par l’agent infectieux, et en particulier, la fraction auto immune de celui-ci.
Les vaccins ne représentent aucun risque chez les patients SEP.
Ils peuvent être un peu moins efficaces chez les patients sous traitement immunomodulateur.
La seule exception est le vaccin contre la fièvre jaune, car il s’agit d’un vaccin à base de virus vivants mais atténués, qui peut être à l’origine de poussées de la maladie.
La surcharge pondérale et l'obésité
Elle pourrait être un facteur de risque supplémentaire de développer une SEP chez les adolescent(e)s. Cependant, ces personnes ont moins d’activités physiques au grand air, des taux de vitamine D plus bas, éventuellement un tabagisme associé... ce qui fait cumuler des facteurs de risque liés au style de vie.
Le rôle éventuel du microbiome (l’ensemble des microbes qui colonisent les intestins) est discuté dans la question suivante.
L'exposition aux solvants organiques
Les solvants organiques sont des produits liquides utilisés pour dissoudre des matériaux solides.
Ils sont présents dans les peintures, les vernis, les produits de nettoyage à sec, les produits adhésifs et les cosmétiques.
Ils peuvent être inhalés ou résorbés par contact avec la peau. Une exposition chronique à ces produits pourrait augmenter le risque de développer une SEP par un facteur de 1,5.
Cependant, une étude récente a montré que le risque était bien plus considérable lorsqu’il y avait simultanément exposition à ces solvants organiques, tabagisme, présence du gène de susceptibilité HLA –DRB1*15 et absence du gène de résistance HLA-A*02.
Ce "cocktail" augmente en effet le risque de développer une SEP par un facteur 30, dans une étude suédoise publiée le 31 juillet 2018.
Le rôle du stress et des traumatismes
Le rôle que jouent le stress et les traumatismes n’est en général pas démontré ni considéré.
Il est en effet difficile d’évaluer leur influence puisque le stress fait partie intégrante de la vie de chaque individu.
Un traumatisme physique ne pourrait être à l’origine d’une poussée que si il y a une relation dans le temps et dans l’espace très étroite (par exemple, traumatisme sur la colonne vertébrale et poussée médullaire au même niveau, dans les quelques jours qui suivent).
De plus en plus, on dit que les intestins jouent un rôle dans l'immunité. On parle de perméabilité intestinale. Y-a-t-il un lien avec la SEP?
Jusqu’à présent, il n’existe qu’un seul exemple de
relation causale entre la présence d’un microbe particulier dans l’intestin et une maladie neurologique. Il s’agit des cas de syndrome de Guillain-Barré associé à la présence d’une souche particulière de Campylobacter jejuni dans l’intestin.
Le syndrome de Guillain-Barré est un trouble neurologique affectant le système nerveux périphérique, d’origine inflammatoire, qui dans 2 cas sur 3, survient après une infection virale ou bactérienne.
Certains cas de syndrome de Guillain-Barré sont apparus après une diarrhée provoquée par Campylobacter jejuni qui peut infecter la viande de poulet mal conservée et mal cuite.
On a pu mettre en évidence que la paroi de ce microbe contenait des molécules semblables à celles des gaines de myéline et des fibres nerveuses du système nerveux périphérique.
Il s’agit donc d’une réaction immunitaire croisée par mimétisme moléculaire, contre l’agent infectieux et contre les fibres nerveuses périphériques, provoquant les paralysies typiques de ce syndrome. Celui-ci est très différent de la SEP car il guérit complètement dans 85 % des cas et en général, il ne récidive pas.
Dans la SEP, la question est de savoir si le microbiome intestinal, c’est-à-dire l’ensemble de toutes les bactéries présentes dans l’intestin (il s’agit de milliards de bactéries la plupart encore inconnues) est différent chez les patients SEP en comparaison de personnes indemnes.
On ne peut étudier ce problème qu’à partir de la récolte des matières fécales.
Or, l’intestin contient différents segments qui ont chacun leur propre flore microbienne. Celle-ci peut être modifiée en fonction de l’âge, du sexe, de l’alimentation, du style de vie.
Toutefois, des expériences préliminaires suggèrent que la flore intestinale microbienne peut être impliquée dans la SEP. Certaines souris élevées dans un environnement totalement stérile développent une encéphalite auto-immune plus fréquemment et plus sévèrement en présence de microbes provenant des selles d’un jumeau "vrai" atteint de SEP, par comparaison aux microbes provenant du jumeau indemne. Chez ces paires de jumeaux discordants, le microbe Akkermansia muciniphila est plus fréquemment rencontré et en plus grande quantité chez le jumeau SEP.
D’autres études ont montré que certains microbes étaient plus fréquents et d’autres moins fréquents dans les matières fécales de patients atteints de SEP par rapport à des contrôles. Ces recherches sont tout à fait débutantes.
Il n’y a pas encore à l’horizon d’essais cliniques portant sur des transplantations de matière fécale. Celles-ci ont déjà été réalisées dans le cadre d’infections par des microbes intestinaux très difficiles à éliminer. Elles peuvent être risquées, provoquer aussi des infections et conduire à des décès.
Une autre constatation faite chez la souris est que si elle reçoit de l’eau riche en sel, son système immunitaire intestinal est beaucoup plus activé que si elle reçoit de l’eau normalement salée. Ces lymphocytes activés peuvent alors aggraver une encéphalite auto-immune induite expérimentalement.
Le lien entre microbiome intestinal, immunité intestinale, immunité générale et auto-immunité spécifique d’organes-cibles doit encore être étudié en profondeur et nous ne sommes qu’au début de ce type de recherche.
On connaît bien les symptômes principaux de la SEP mais moins bien les symptômes plus discrets ou moins visibles. Quels sont-ils?
Les symptômes les plus visibles de la SEP concernent les troubles de la marche et de l’équilibre. Cependant, même ces symptômes peuvent être discrets ou relativement cachés en début de maladie, et n’apparaître qu’après un effort physique plus ou moins prolongé. C’est ainsi qu’une personne SEP peut marcher normalement sur quelques dizaines ou centaines de mètres, voire plusieurs kilomètres, puis remarquer l’apparition progressive d’un frottement du pied, une lourdeur d’une jambe, une faiblesse des releveurs du pied et un trébuchage plus fréquent.
De même, à l’effort, un trouble de l’équilibre peut s’accentuer et la marche devenir plus déséquilibrée et instable. La coordination d’une jambe peut aussi être diminuée à l’effort et le patient doit garder un contrôle visuel sur ses pieds pour les placer au bon endroit.
Toujours à l’effort, même réduit, peuvent apparaître des fourmillements dans les pieds remontant dans les jambes. Ces fourmillements parfois n’apparaissent qu’à l’arrêt de l’effort. Dans tous les cas, ces symptômes moteurs ou sensitifs disparaissent après une période de repos relativement courte, le plus souvent en position assise. Les mécanismes de ces phénomènes relèvent de ce que l’on a appelé une "claudication médullaire", c’est-à-dire d’un ralentissement et d’un blocage progressif des impulsions nerveuses au niveau de la moelle épinière en fonction de la demande énergétique.
Un autre symptôme caché est la présence de douleurs chez environ 50 % des patients. Ces douleurs dites neuropathiques font l’objet de la question n° 9.
Les troubles sphinctériens sont aussi peu remarqués par l’entourage et beaucoup mieux perçus par la personne elle-même. Il s’agit le plus souvent de besoins urinaires urgents nécessitant de se rendre aux toilettes très rapidement et souvent plus fréquemment. Ces mictions impérieuses peuvent être, dès lors, à l’origine d’incontinences d’urgence.
Elles proviennent d’une hyper-réactivité du muscle de la vessie appelé détrusor. La vessie peut aussi ne pas se vider complètement au moment de la miction et en cas de résidus importants, des infections urinaires surviennent régulièrement. Le volume maximal d’urines toléré après une miction est de 100 ml.
Un autre phénomène peut apparaître, c’est le manque de synergie entre la contraction du détrusor et le relâchement des sphincters de la vessie. Il en résulte un paradoxe, à savoir un besoin urinaire urgent mais une difficulté d’initier la miction lorsque l’on se présente aux toilettes. Les conséquences des troubles de la vessie peuvent être importantes avec infections remontant jusqu’aux reins et septicémie. La personne doit vivre avec une vessie qui ne se remplit pas complètement et qui ne se vide pas complètement. L’avis d’un urologue est souvent déterminant.
À noter que les mêmes symptômes d’urgences et éventuellement d’incontinences peuvent être présents au niveau du sphincter anal.
Un autre symptôme caché est un trouble de l’érection chez le patient masculin atteint de SEP, suite à la présence de lésions médullaires. Ces troubles de l’érection sont souvent associés aux troubles vésicaux. Chez la femme, une diminution de la sensibilité du périnée et une diminution des sécrétions vaginales peuvent rendre l’acte sexuel douloureux et empêcher l’orgasme. La crainte de problèmes urinaires concomitants à l’acte sexuel peut aggraver l’inhibition de celui-ci.
Mais les troubles les plus fréquents tout en restant cachés et difficiles à détecter ou à mesurer même par la personne SEP concernent les troubles cognitifs, la fatigue et les changements de caractère.
Les troubles cognitifs perturbent la mémoire visuelle et la mémoire verbale (l’information apportée par le langage via les voies auditives) pour les faits récents, les troubles d’apprentissage, la flexibilité mentale qui permet le passage fluide d’une activité à une autre, et la rapidité d’exécution des tâches cognitives. Ces troubles s’installent souvent insidieusement et la personne peut ne pas s’en rendre compte avant plusieurs années, quand elle sera mise en difficulté dans son activité professionnelle ou simplement dans la gestion de son ménage.
Ces troubles cognitifs sont relativement corrélés au nombre de lésions de la substance blanche cérébrale et en particulier des lésions frontales. Ils sont encore mieux corrélés avec l’atrophie du thalamus qui est un centre de relais important et qui est impliqué dans l’activation générale du cerveau. De même, l’atrophie du corps calleux joue un rôle important dans ces troubles cognitifs, car il contient toutes les fibres nerveuses connectant l’hémisphère droit à l’hémisphère gauche et inversement. Les plaques de démyélinisation provoquent donc des déconnexions et des dysconnexions entre les différentes zones du cerveau puisqu’au niveau de ces plaques, la vitesse de l’influx nerveux est fortement réduite et le nombre de fibres nerveuses peut être diminué par transsection* et dégénérescence secondaire. Plus que le nombre total de plaques, il semble que la localisation de certaines d’entre elles joue un rôle important dans ce que l’on appelle la connectivité cérébrale.
On peut comparer tous les faisceaux nerveux des hémisphères cérébraux à des voies aériennes avec leurs "hubs" (plaques tournantes) et leurs dispersions secondaires. Les plaques localisées dans des zones hautement connectées auront des conséquences néfastes plus marquées sur les capacités de fonctionnement du cerveau.
Il s’agit d’un champ de recherche important qui va au-delà de la SEP et qui s’intéresse au "connectome", c’est-à-dire l’étude des connexions entre les différentes régions cérébrales.
Un autre symptôme caché de la maladie est la fatigue. Il faut ici distinguer la fatigue primaire due directement à la maladie, de la fatigue secondaire consécutive à des troubles du sommeil, à la prise de médicaments anti-douleur, à une démusculation ou à une inactivité prolongée.
La fatigue primaire due directement à la maladie survient souvent par à-coups, et est comparée à une lassitude extrême. Elle consiste en une perte de l’énergie physique et/ou mentale nécessaire pour réaliser les activités habituelles souhaitées. Dans cette fatigue primaire, là aussi, l’atrophie du corps calleux pourrait jouer un rôle important.
Les changements de caractère sont aussi fréquents dans la maladie, même s’ils peuvent passer inaperçus initialement.
Il s’agira surtout d’une impulsivité excessive et d’un manque de contrôle de ses émotions. Ces troubles proviennent de lésions situées dans le lobe frontal et d’une perturbation des mécanismes auto-inhibiteurs de l’émotivité. Il en résulte souvent des comportements de type "soupe au lait" que le patient se reproche ensuite, et qui peuvent altérer une relation familiale, amicale ou professionnelle.
A l’inverse, une autre facette du syndrome frontal est caractérisée par une apathie, une euphorie relative et un détachement émotionnel incompréhensible pour l’entourage.
A côté des antidépresseurs, des régulateurs de l’humeur, du soutien psychologique et des techniques de relaxation et de "mindfulness", le meilleur traitement est préventif et consiste à freiner au maximum l’accumulation de lésions cérébrales avant qu’un seuil critique ne soit atteint et que ces symptômes ne deviennent évidents.
Qu'est-ce qu'une douleur neuropathique?
Comment la traiter?
On distingue habituellement deux types de douleur, la douleur inflammatoire et la douleur neuropathique. La douleur inflammatoire représente la réponse d’un système de perception de la douleur qui est normal et qui est soumis à un stimulus douloureux prolongé. On y retrouve les douleurs ostéo-articulaires, souvent localisées et augmentées de manière mécanique par un mouvement ou une position, viscérales, musculaires ou les douleurs cutanées occasionnées par un traumatisme ou par une brûlure.
À l’opposé, la douleur neuropathique est la conséquence d’un dysfonctionnement ou d’une lésion structurale du système nerveux lui-même, que ce soit dans sa partie périphérique (douleurs post-zona, par exemple) ou dans sa partie centrale (douleurs post-thrombose cérébrale par exemple ou sur plaques de SEP). Elle est présente chez 50 % des patients SEP environ et peut être spontanée en dehors de toute stimulation.
Elle peut être aussi provoquée par une stimulation qui ne devrait produire qu’une sensation douloureuse minime (il s’agit alors d’une hyperalgésie) ou par une stimulation normalement non douloureuse, comme un effleurement (on parle alors d’allodynie). Les caractéristiques d’une douleur neuropathique sont souvent décrites comme une brûlure, sensation de froid douloureux, striction ou garrot, décharges électriques possibles, fourmillements, piqûres d’ortie, diminution de la sensibilité à la piqûre ou au contraire hypersensibilité à la piqûre. L’extrême en est l’anesthésie douloureuse, c’est-à-dire une douleur ressentie dans une zone où la sensibilité a été perdue.
Les mécanismes qui sont à la base de douleurs chroniques consécutives à une lésion du SNC comme dans la SEP, sont encore mal connus. Il y a cependant toujours une atteinte des voies nerveuses avec déficit thermo–algique*. Cette atteinte peut provoquer une hypersensibilité des récepteurs à la douleur ainsi qu’une désinhibition des fibres nerveuses qui déchargent spontanément. Les voies nerveuses thermo-algiques sont présentes tout au long de la moelle épinière, dans le thalamus, et les projections du thalamus vers le cortex cérébral.
Le traitement de ces douleurs neuropathiques est difficile. Les médicaments antalgiques habituels n’ont pas une grande efficacité.
En pratique, on utilise essentiellement des médicaments de type anti-épileptique. Il s’agira de la carbamazépine (Tégrétol), Gabapentine (Neurontin), Prégabaline (Lyrica). Le clonazépam (Rivotril) est aussi utilisé mais induit une forte somnolence. D’anciens antidépresseurs tels que l’Amitryptiline (Tryptizol, Redomex) ou la Duloxetine (Cymbalta) ont aussi un rôle dans le traitement des douleurs neuropathiques. Le but est de les atténuer. Nos médications sont plus actives contre les décharges douloureuses que contre le fond chronique de type brûlure. On a longtemps pensé que les opiacés étaient inefficaces dans le traitement des douleurs neuropathiques.
Des études plus récentes ont montré que ces substances pouvaient avoir une action réellement bénéfique mais que la variabilité entre individus était considérable, certains patients étant soulagés et d’autres non.
En général cependant, le traitement des douleurs neuropathiques par les opiacés nécessite une posologie nettement plus élevée que pour les douleurs inflammatoires.
En pratique, chez le patient SEP, il faut d’abord distinguer les douleurs neuropathiques des autres douleurs de type inflammatoire, telles que tendinites (épicondylite, trochantérite...), douleurs arthrosiques (région lombaire, hanche, genou...), douleurs musculaires sur spasticité, douleurs de périarthrite de l’épaule...
Que faire si la douleur résiste au traitement?
En cas de douleurs résistantes à tout traitement médicamenteux classique, il est nécessaire de s’adresser à un centre d’algologie spécialisé. On pourra y discuter de l’intérêt d’utiliser des dérivés cannabinoïdes (Sativex), de réaliser des stimulations percutanées ou intra-rachidiennes ou intra-cérébrales sur le cortex par des électrodes implantées localement.
Pourquoi faut-il impérativement combattre la fièvre?
Les fibres nerveuses qui ont perdu leur gaine de myéline dans les zones de démyélinisation (plaques) voient leur vitesse de conduction de l’influx nerveux très fortement diminuée, de 90 % environ, par rapport aux fibres nerveuses normalement myélinisées.
La gaine de myéline joue un rôle d’isolant thermique: lorsque la température du corps augmente même de quelques dixièmes de degré, la vitesse de conduction nerveuse est encore plus fortement ralentie.
Ceci explique la réapparition d’anciens symptômes ou l’aggravation des symptômes existants pendant toute la durée de l’augmentation de la température corporelle.
Celle-ci peut être augmentée par un simple effort physique, l’ingestion de boissons très chaudes, un bain de soleil, et la fièvre en cas d’infection.
Cette réapparition ou augmentation des symptômes n’est pas une poussée et la définition d’une poussée exclut le fait d’avoir une température corporelle élevée et donc de la fièvre.
En principe, les symptômes induits par l’augmentation de la température corporelle sont réversibles lorsque celle-ci revient à des valeurs normales.
Il faut noter que toutes les personnes SEP ne sont pas sensibles à ces variations de température mais seulement une minorité d’entre elles.
Ce mécanisme explique un phénomène particulier appelé phénomène d’Uhthoff, présent chez les personnes qui ont souffert d’une névrite optique et qui en ont bien récupéré.
Lorsqu’elles font un effort physique tel que du jogging, ou une marché rapide, ou une montée d’escaliers, un flou visuel peut réapparaître devant l’œil qui a été touché par la névrite optique et ce, pendant quelques minutes.
La SEP prédispose-t-elle à certaines autres maladies et si oui, pourquoi?
En principe, la SEP ne prédispose pas directement à d’autres maladies. Comme les facteurs génétiques de susceptibilité sont communs à d’autres maladies auto-immunes, telles que la polyarthrite rhumatoïde, le lupus érythémateux, le psoriasis, le diabète juvénile, la maladie de Crohn, certains patients souffrent à la fois d’une SEP et de l’une ou l’autre de ces maladies. Il ne s’agit pas alors d’une association fortuite.
De même, la fréquence d’une thyroïdite auto-immune est plus élevée chez des patients présentant une SEP. Il y a 10 fois plus fréquemment d’uvéite, c’est- à-dire une atteinte inflammatoire des yeux, chez les personnes SEP que dans la population générale. Dans ces cas, la maladie auto-immune associée évolue indépendamment de la SEP, avec ses propres poussées et ses rémissions, et doit être traitée spécifiquement et indépendamment de la SEP.
Ces maladies auto-immunes se retrouvent aussi plus fréquemment dans la famille des personnes atteintes de SEP.
Par ailleurs, la perte de mobilité, le manque d’exercice physique, peuvent provoquer une prise de poids excédentaire, et des troubles métaboliques avec perturbation des lipides sanguins, diabète, athérosclérose, et maladies cardio-vasculaires. Les infections ne sont pas plus fréquentes chez les personnes atteintes de SEP et c’est même souvent le contraire qui est observé.
Il y a moins d’infections virales des voies respiratoires supérieures par exemple. Les infections peuvent être secondaires aux problèmes urinaires avec cystite et pyélonéphrite, ou à des troubles de déglutition avec pneumonie d’inhalation ou à des escarres infectés. On n’a pas observé d’augmentation du nombre de cancers chez les patients SEP.
Quel est le rôle de la vitamine B12?
Le rôle de la vitamine D a été discuté à la question 6 dans les facteurs environnementaux susceptibles de favoriser le développement d’une SEP. Vu son activité immunomodulatrice, par principe de précaution, il faut maintenir des taux sanguins normaux chez les patients SEP.
La vitamine B12 est résorbée par un mécanisme spécial au niveau de l’estomac et est surtout abondante dans la viande.
En cas de maladie gastrique et atrophie de la muqueuse de l’estomac (qui peut être aussi d’origine auto-immune), il peut y avoir un déficit de résorption de la vitamine B12.
Lorsque le déficit en vitamine B12 est important et prolongé, on peut voir apparaître les symptômes d’une "neuro-anémie".
L’anémie consiste en une diminution du nombre de globules rouges dont le volume est cependant plus important que normalement, et en une chute du taux total d’hémoglobine.
La symptomatologie neurologique de la déficience en vitamine B12 est consécutive à une mauvaise synthèse des gaines de myéline principalement au niveau de la moelle épinière. Il en résulte des troubles sensitifs et moteurs particulièrement dans les membres inférieurs qui ressemblent à ce que des plaques de SEP dans la moëlle épinière peuvent provoquer.
Ceci montre que la vitamine B12 est nécessaire à la fabrication et au bon fonctionnement des gaines de myéline.
Il est donc important que le taux de vitamine B12 soit toujours satisfaisant chez les personnes atteintes de SEP afin de ne pas ajouter un mécanisme de déficience vitaminique à la pathologie inflammatoire de la SEP.
Il faut insister sur le fait que les végétariens stricts doivent prendre des suppléments de vitamine B12 sous peine d’être en déficit chronique de cette vitamine.
On parle de possibilité de remyélinisation: qu'en est-il?
Est-ce valable pour toute forme de SEP?
Il existe des possibilités de remyélinisation même dans un cerveau humain adulte et nous savons que dans les formes avec poussées et rémission, certaines lésions peuvent être remyélinisées grâce à des cellules précurseurs de l’oligodendrocyte ("oligodendrocyte precursor cells" ou OPC). Ces cellules précurseurs peuvent se transformer en oligodendrocytes matures qui formeront la gaine de myéline au niveau de la fibre nerveuse démyélinisée.
La nouvelle gaine sera généralement plus fine que la gaine initiale, et elle pourra aussi faire l’objet d’une nouvelle attaque immunitaire en cas de poussées récurrentes. Sur le plan anatomique, on peut reconnaître les plaques remyélinisées qui sont plus floues dans leurs contours et qu’on appelle "plaques fantômes" ("shadow plaque"). Ce processus est cependant partiel et devient insuffisant en cas d’évolution de la maladie et de lésions multiples.
Pour parvenir à une remyélinisation efficace, il faut donc avoir à sa disposition des cellules précurseurs de l’oligodendrocyte, des stimuli transformant ces cellules en oligodendrocytes matures, et des fibres nerveuses restées intactes après la destruction de leur gaine.
Ceci est un élément crucial puisque certaines de ces fibres nerveuses peuvent être transsectées* et d’autres peuvent dégénérer lentement avec le temps en ayant perdu leur gaine protectrice. Le problème de la remyélinisation est donc directement lié à celui de la préservation des fibres nerveuses, c’est-à-dire à la neuroprotection de ces fibres tant au moment de l’inflammation active que de manière plus chronique lors d’un processus éventuel de dégénérescence secondaire.
Les difficultés rencontrées sont donc multiples. En premier lieu, la remyélinisation est très difficile à mesurer de manière clinique et l’IRM a une spécificité insuffisante pour démontrer une remyélinisation. En deuxième lieu, les capacités de régénération de la myéline varient très fortement d’une personne SEP à l’autre alors que ces possibilités sont mieux connues et plus prévisibles chez les rongeurs, par exemple. Enfin, les capacités de remyélinisation diminuent chez tout le monde avec l’âge et plus le temps passe, plus les possibilités de remyélinisation deviennent faibles.
Il est certain aussi qu’il existe des facteurs inhibiteurs de la remyélinisation au niveau des plaques. Certains de ces facteurs peuvent être des lipides libérés par la destruction de la gaine de myéline, et en particulier le cholestérol qui se cristallise. Les cellules chargées d’éliminer ces lipides peuvent être aussi des facteurs inhibiteurs de la reconstruction de la myéline. Le processus de cicatrisation par hypertrophie des cellules appelées astrocytes entraîne une cicatrice fibreuse qui peut s’opposer mécaniquement à la reconstruction de la gaine de myéline.
De nombreuses études sont en cours avec des nouvelles molécules pour analyser le processus de remyélinisation. Ces études se font sur cultures cellulaires ou chez des rongeurs et mettront beaucoup de temps à pouvoir être transposées au cerveau humain adulte. Deux études de phase 2 ont cependant déjà été réalisées dans la névrite optique provoquée par la SEP, l’une avec un anticorps bloquant une protéine inhibant la maturation des oligodendrocytes (anti-LINGO), l’autre avec un médicament anti-histaminique (clémastine). Des résultats partiellement positifs ont été observés, mais jamais au point d’améliorer significativement l’acuité visuelle des patients recevant le produit actif.
Vu le rôle crucial du système immunitaire dans la SEP, de quelle manière celui-ci est-il impacté par les traitements immunomodulateurs actuels?
À l’exception des traitements symptomatiques dirigés contre des symptômes spécifiques de la maladie, et des traitements paramédicaux tels que kinésithérapie, logopédie, ergothérapie, tous les traitements utilisés actuellement dans la SEP ont une action directe sur le système immunitaire en vue de le désactiver partiellement, de normaliser son fonctionnement si possible, et d’empêcher les lymphocytes auto-réactifs agressifs de pénétrer dans le SNC. Cela est vrai aussi bien pour les dérivés de cortisone utilisés en cas de poussées, que pour les traitements au long cours appelés immunomodulateurs.
En cas de poussée avec impact significatif sur les activités de la vie quotidienne, le traitement de choix repose sur un dérivé synthétique de cortisone généralement donné à haute dose par voie intraveineuse, soit 1 g de méthylprednisolone par jour durant 3 à 5 jours, parfois 7 et jusqu’à 10 jours en cas de poussées très sévères. Certains auteurs utilisent le même produit aux mêmes doses mais par voie orale avec des résultats globalement similaires à ceux obtenus par voie intraveineuse.
La cortisone provoque la mort des lymphocytes activés et diminue la synthèse d’une enzyme permettant à ces lymphocytes de perforer la barrière hémato-encéphalique et de pénétrer dans le SNC. Le traitement à forte dose mais bref permet d’éviter les effets secondaires que l’on rencontre le plus souvent en cas de traitement prolongé par voie orale.
Il doit cependant être réalisé sous surveillance médicale car il peut provoquer des troubles ioniques*, des troubles de la tension artérielle, des palpitations cardiaques, de la nervosité, des insomnies et après l’arrêt du traitement, des douleurs tendineuses ou musculaires et une fatigue importante. Alors que les plaques actives prennent le produit de contraste de l’IRM en moyenne durant 6 à 8 semaines, un traitement par méthylprednisolone permet d’inhiber cette prise de contraste en une dizaine de jours. À noter que ce produit ne traverse pas la barrière placentaire et peut donc être utilisé en cas de poussées survenant durant la grossesse. La cortisone n’a pas d’action préventive sur la survenue des poussées ultérieures.
Les traitements immunomodulateurs au long cours sont utilisés dans les formes avec poussées et rémission et dans les formes secondaires progressives actives telles que définies dans la question 2. Ces traitements peuvent être divisés en 4 catégories suivant leurs modes d’action:
- 1° les médicaments modulant le fonctionnement du système immunitaire dans le sens d’une meilleure régulation: les interférons bêta (Bêtaféron, Rebif, Avonex, Plegridy); l’acétate de glatiramère (Copaxone®); le diméthylfumarate (Tecfidera®).
- 2° les médicaments inhibant de manière ciblée la multiplication et la prolifération des lymphocytes activés: le tériflunomide (Aubagio®); la cladribine (Mavenclad®).
- 3° les médicaments interférant avec la circulation des lymphocytes: natalizumab (Tysabri)®; le fingolimod (Gilenya®).
- 4° les médicaments détruisant une population particulière de lymphocytes: l’alemtuzumab (Lemtrada®), l’ocrélizumab (OcrévusTM).
Ces médications sont aussi divisées en médicaments de première ligne (tous ceux du 1er groupe ainsi qu’Aubagio®) et en médicaments de deuxième ligne (tous ceux des groupes 3 et 4 ainsi que le Mavenclad®). Les médicaments de 2e ligne ne sont disponibles qu’en pharmacies d’hôpital et ne sont utilisés qu’en cas d’échec des médicaments de première ligne OU dès le début de la maladie et de son diagnostic, en cas de formes d’emblée très actives et agressives avec poussées rapprochées et au moins une lésion active en IRM.
À l’heure actuelle, nous ne pouvons pas prévoir si un patient individuel sera un bon ou un mauvais répondeur à n’importe lequel de ces traitements, et nous ne pouvons pas non plus prévoir s'il développera ou non, des effets secondaires importants. Tous ces traitements exigent donc une surveillance continue tant sur le plan de l’efficacité que sur le plan des effets secondaires potentiels. Ceux-ci seront discutés en réponse à la question suivante.
Les interférons bêta sont des substances naturelles que nous produisons tous et qui ont des propriétés anti-virales car ils "interfèrent" avec la réplication virale*. Les interférons bêta sont des antagonistes de l’interféron gamma et ont été étudiés dans la SEP parce qu’un essai clinique avec l’interféron gamma a résulté en une augmentation du nombre de poussées et non en une diminution de celles-ci ! Le Bêtaféron a été commercialisé en Belgique en 1996 et le Rebif en 1998. Nous avons donc un recul de 20 ans avec ces molécules que nous connaissons bien. Elles n’ont pas provoqué d’effets secondaires indésirables à long terme. Le Plegridy est un interféron retard à longue durée d’action qui ne nécessite qu’une seule injection sous-cutanée tous les 14 jours. Les interférons ont une action extrêmement polymorphe* sur le système immunitaire car ils interagissent avec pas moins de 3000 gènes soit en augmentant leur expression soit en les inhibant.
La Copaxone® est la seule médication qui a été spécifiquement synthétisée et appliquée au traitement de la SEP. Il s’agit d’un petit polymère* composé de différents acides aminés* synthétisés initialement pour provoquer l’encéphalite auto-immune chez la souris. Les résultats observés ont été à l’opposé de ce qui était attendu, car ce polymère protégeait la souris de l’encéphalite ! À partir de cette constatation, la molécule a été synthétisée et testée en clinique par voie sous-cutanée (la voie orale est inefficace). Elle joue un rôle de fausse cible pour les lymphocytes activés et dévie la réaction immunitaire pro- inflammatoire vers une réaction anti-inflammatoire. Les lymphocytes activés contre la Copaxone ont en effet des propriétés immunorégulatrices qui diminuent la réaction inflammatoire à l’intérieur même du SNC. Ce produit a été utilisé depuis 1995 d’abord à titre compassionnel et s’est révélé tout à fait dépourvu d’effets secondaires à long terme.
Aubagio® est un médicament inhibant spécifiquement la prolifération des lymphocytes activés. C’est un dérivé d’un autre produit utilisé en rhumatologie. Il peut s’accumuler dans l’organisme mais peut être éliminé dans les selles en une dizaine de jours par l’utilisation d’un antidote spécifique. Il se prend à la dose d’un comprimé/jour.
Tecfidera® est dérivé d’un produit utilisé pendant de nombreuses années contre le psoriasis en Allemagne. Ce médicament se prend à la dose de 2 comprimés/ jour. Il stimule des enzymes antioxydantes qui limitent l’inflammation cérébrale mais tous ses mécanismes d’action ne sont pas encore connus.
Tysabri® est un anticorps monoclonal qui est donné en perfusion toutes les 4 semaines, et qui bloque une protéine à la surface des lymphocytes activés, ce qui les empêche de traverser la barrière hémato- encéphalique et de passer du sang vers le cerveau ou vers la moelle épinière. Il a été testé aussi dans la maladie de Crohn. Cette médication est rapidement très efficace, mais elle empêche la surveillance immunitaire normale du cerveau, ce qui augmente le risque d’une éventuelle encéphalite virale appelée leuco-encéphalite multifocale progressive (LEMP), risque rencontré uniquement chez les porteurs du virus "JC".
Gilenya® est un médicament par voie orale à la dose d’un comprimé/jour, qui bloque certaines populations de lymphocytes, dont les lymphocytes activés, dans les ganglions lymphoïdes et les empêche de circuler dans le sang et donc de passer éventuellement à travers la barrière hémato-encéphalique vers le SNC. Il a d’abord été testé contre le rejet des greffes. Ce médicament permet cependant la circulation normale des "lymphocytes mémoire" qui protègent l’organisme contre une ré-infection par des agents infectieux rencontrés précédemment.
Lemtrada® est un anticorps monoclonal* qui provoque la destruction de nombreux lymphocytes durant les 5 jours d’infusion intra-veineuse durant la première semaine du traitement. Celui-ci est complété un an plus tard par une infusion de 3 nouvelles doses. Ce traitement a été aussi utilisé dans les leucémies. Le système immunitaire est dès lors fortement modifié par la destruction de ces lymphocytes, mais se reconstitue ensuite progressivement au cours des mois et des 2 à 3 ans qui suivent. On espère que cette reconstitution d’un "nouveau" système immunitaire se fera de manière à ce qu’il n’y ait plus de cellules auto-agressives dans la composition des lymphocytes. Ce traitement peut amener 50 % des patients à une rémission de plusieurs années, sans autre médication supplémentaire.
OcrévusTM est un anticorps monoclonal qui détruit les lymphocytes B. Ceux-ci représentant 10 % environ des lymphocytes totaux. Il ne détruit pas les lymphocytes B matures (plasmocytes) qui synthétisent les anticorps. Son efficacité est, elle aussi, très importante et incontestable, mais on ignore encore à ce jour les conséquences à long terme d’une suppression continue des lymphocytes B dans l’organisme.
Mavenclad® est un médicament pris par voie orale durant les 5 premiers jours du traitement puis durant 5 jours le mois suivant, puis à nouveau un an plus tard lors d’une 2ème cure de 2 x 5 jours. Il agit de manière prolongée contre la prolifération des lymphocytes activés et est donc susceptible d’induire une rémission à long terme. Ce produit a d’abord été utilisé dans le traitement des leucémies par voie intra-veineuse. Les études ont montré une efficacité remarquable mais les récidives à long terme sont possibles et les éventuels effets secondaires tardifs sont encore inconnus.
| Nom | Mode d’administration | Posologie |
| Interférons bêta | Voie sous cutanée ou intra-musculaire | Fréquence variable suivant la molécule |
| Copaxone® | Injection sous cutanée | Fréquence variable selon le dosage |
| Aubagio® | Vie orale | 1 comprimé/jour |
| Tecfidera® | Vie orale | 2 comprimé/jour |
| Tysabri® | Infusions intra-veineuses | 1fois/4 semaines |
| Gilenya® | Vie orale | 1 comprimé/jour |
| Lemtrada® | Infusions intra-veineuses | 5 jours (5 doses) au début du traitement
3 jours (3 doses) 1 an plus tard |
| OcrévusTM | Infusions intra-veineuses | 2 fois une demi-dose à 15 jours d'intervalle puis
une dose complète tous les 6 mois |
| Mavenclad® | Vie orale | 2x5 jours au début du traitement à 1 mois d'intervalle puis 2 x 5 jours 1 an plus tard |
Le statut "NEDA", acronyme anglais signifiant "Non Evidence of Disease Activity", ou absence d’évidence de maladie active, est devenu l’objectif à atteindre dans le traitement de la SEP rémittente. Le NEDA est défini par plusieurs composantes cliniques et radiologiques:
La première composante ("NEDA 1") est l’absence de toute poussée de la maladie sur l’intervalle de temps considéré.
NEDA 2 est l’absence de progression de la maladie telle que définie par l’échelle d’invalidité spécifique de la SEP, appelée échelle EDSS, et ce, sur une période minimale de 6 mois.
NEDA 3 est l’absence de nouvelles lésions en résonance magnétique, l’absence d’une augmentation du volume d’une ancienne lésion de plus de 10 %, et l’absence de lésions inflammatoires actives prenant le produit de contraste.
NEDA 4 est utilisé dans les études cliniques et n’est pas encore disponible dans la pratique quotidienne. Il s’agit de la mesure du volume cérébral qui diminue en moyenne de 0,2% par an chez les sujets normaux, mais qui dans la SEP peut diminuer de plus de 0,4% par an. NEDA 4 est obtenu si l’atrophie cérébrale annuelle est inférieure à ce chiffre de 0,4%.
Il faut noter que ces 4 composantes ne sont pas indépendantes l’une de l’autre. Une poussée de la maladie sera souvent accompagnée d’une nouvelle lésion prenant le produit de contraste, l’aggravation de l’échelle EDSS est corrélée avec une diminution excessive du volume cérébral.
Avoir un "statut NEDA" signifie que nos méthodes actuelles pour détecter l’activité de la maladie ne révèlent aucun signe de celle-ci et qu'elle peut être considérée comme inactive et stabilisée. C’est bien sûr le but de nos traitements: obtenir une rémission de longue durée et de bonne qualité, mais pas encore de réparer les lésions existantes.
Certaines personnes souffrant de SEP peuvent avoir spontanément, sans traitement, un statut NEDA. C’est ce que l’on observe dans les études avec groupes placebo. En effet, 10 à 15 % des personnes ne recevant aucun traitement actif, mais seulement un placebo, ne présentent pas de signes de maladie active et évolutive et sont spontanément en NEDA. Par contre, un très bon répondeur à son traitement entrera dans un statut NEDA grâce à celui-ci. Le paradoxe du statut NEDA est donc qu’il peut être observé aussi bien chez des personnes avec une forme inactive de la maladie ne nécessitant aucun traitement que chez des personnes répondant de manière excellente à leur traitement.
Le concept NEDA est un concept évolutif. On peut perdre ce statut NEDA après quelques années parce que la maladie redevient plus active ou parce que le traitement en cours n’est plus suffisant. Il permet donc, soit d’instaurer un traitement, soit de changer de traitement sur des bases plus objectives.
La définition du statut NEDA est cependant encore trop exigeante par rapport à la plupart de nos traitements actuels. Il s’agit dès lors de définir le seuil de tolérance minimale que l’on peut accepter dans l’activité de la maladie. C’est ainsi que l’apparition en IRM de 2 petites lésions millimétriques en un an, sans poussée et sans aggravation du handicap, ne signifie pas un échec du traitement en cours et ne justifie pas un changement de traitement. On parlera alors d’un statut "MEDA" (Minimal Evidence of Disease Activity). Mais si les signes d’activité de la maladie sont plus importants, il y aura lieu de passer d’un traitement de première ligne à un traitement de deuxième ligne, ou de changer de traitement de deuxième ligne si on bénéficie déjà d’un traitement de ce type.
Quels sont les effets secondaires des nouveaux traitements?
Quels sont les risques et les alternatives éventuelles?
Quand on manipule le système immunitaire, on doit s’attendre à deux types de risques majeurs, la survenue d’infections plus sévères ou inhabituelles d’une part, la survenue de cancer d’autre part. C’est donc à ces deux types d’effets secondaires que l’on sera très attentif, durant les études cliniques de phase 2 et de phase 3, ainsi que durant les phases d’extension de ces études.
Les interférons bêta et la Copaxone ne posent pas de problèmes spécifiques au niveau infectieux ou néoplasique. Le Tecfidera peut provoquer chez certains patients une lymphopénie c’est-à-dire une diminution de nombre de lymphocytes circulant dans le sang, dont le mécanisme est encore mal connu. La règle est de ne pas poursuivre ce traitement si le nombre de lymphocytes devient inférieur à 500/μL pendant plus de 6 mois.
De très rares cas de LEMP ont été rapportés avec ce produit. Les interférons bêta, la Copaxone et le Tecfidera sont généralement stoppés durant la grossesse à partir du moment où le test de grossesse est positif. La Copaxone peut même être poursuivie sans interruption durant la grossesse si le neurologue traitant le juge utile. Ces éléments prouvent leur innocuité générale.
Aubagio peut être responsable d’une hépatite allergique durant les 6 premiers mois de traitement. Cette hépatite est tout à fait réversible à l’arrêt du traitement mais impose un contrôle mensuel initial de la biologie sanguine. Les autres effets secondaires d’Aubagio consistent en diarrhées et légère perte de cheveux réversible durant les 3 premiers mois, et sont donc parfaitement gérables. En cas de souhait de grossesse, il faut d’abord éliminer totalement Aubagio en prenant de la colestyramine pendant 11 jours.
De manière générale, les médicaments de 2ème ligne peuvent comporter des risques plus importants. La survenue d’un zona a été décrite un peu plus fréquemment que chez les personnes recevant un placebo, mais ces zonas sont modérés et ne sont pas plus étendus que chez des sujets normaux.
D’autres infections opportunistes plus rares ont été décrites mais le danger principal vient de la LEMP due au virus JC*, surtout chez les personnes traitées par Tysabri pendant plus de 2 ans et porteuses d’un taux d’anticorps élevé. Ce taux d’anticorps est calculé en fonction d’un index et un index >0,9 avec une durée de traitement >2 ans, entraîne un risque de ce type d’encéphalite chez une personne sur 100. Ce pourcentage est encore plus élevé si les patients concernés ont reçu préalablement des traitements immunosuppresseurs (Imuran, Endoxan, Novantrone...).
En cas de souhait de grossesse, le Tysabri peut être arrêté lorsque le test de grossesse est positif ou même poursuivi pendant les deux premiers trimestres pour éviter un phénomène de rebond de la maladie.
Le Gilenya induit une diminution du nombre des lymphocytes, qui ne doit pas être inférieur à 200/ μl. La toute première prise peut provoquer un ralentissement de la fréquence cardiaque et doit être réalisée sous surveillance en clinique. Il doit être arrêté 3 mois avant d'initier une grossesse.
Le Lemtrada peut provoquer des maladies auto- immunes secondaires survenant généralement dans les 4 ans qui suivent le dernier cycle de traitement. Près d’un tiers des patients peuvent développer des troubles thyroïdiens et beaucoup plus rarement une chute des plaquettes sanguines et des problèmes rénaux. Il est donc nécessaire de faire un contrôle biologique mensuel au moins durant 5 ans, pendant et après le traitement.
Les effets secondaires du Mavenclad sont peu marqués à court terme mais là encore, on ignore l'apparition de rares effets secondaires potentiels survenant plusieurs années après le traitement. En principe, une grossesse est contre-indiquée durant le traitement et jusqu’à 6 mois après la dernière prise du médicament. Pour ce produit, et lui seul, il est recommandé que les patients masculins traités évitent d’induire une grossesse chez leur partenaire durant la même période. Le risque théorique de malformation véhiculée par le spermatozoïde est cependant très faible.
Ocrévus présente aussi peu d’effets secondaires immédiats durant le traitement, hormis les réactions allergiques lors des infusions intra-veineuses, et surtout lors de la première infusion. C’est pourquoi la dose de celle-ci est divisée en deux, avec deux baxters à 15 jours d’intervalle, puis une dose complète tous les 6 mois.
Nous en ignorons par contre les effets secondaires à long terme, en particulier sur le taux d’anticorps dans le sang. Ce produit, en tout cas, diminue généralement l’efficacité des vaccins, hormis le vaccin contre la grippe.
Le choix d’un traitement sera donc toujours une balance entre les bénéfices, c’est-à-dire l’arrêt et la stabilisation de la maladie, et les risques d’effets secondaires parfois graves.
Ce rapport bénéfice – risque doit être discuté avec chaque patient. Les décisions sont parfois difficiles à prendre. Certains patients refusent ou reportent des traitements qui pourraient leur être cependant bénéfiques, par peur d’un risque qui reste rare ou exceptionnel.
Il faut prendre aussi conscience de la gravité de la SEP et de son côté "vicieux" puisqu’elle peut continuer à évoluer à bas bruit avec accumulation de lésions, sans que l’on s’en rende compte immédiatement, avec des conséquences particulièrement sur les fonctions cognitives à moyen et à long terme.
C’est donc au neurologue de bien expliquer l’évolution potentiellement grave de la maladie et de décrire clairement les effets secondaires des médicaments proposés, sans dramatisation, mais avec lucidité.
C’est un contrat de confiance qui doit s’établir, pour concilier le souhait du patient de voir sa maladie stabilisée en prenant le moins de risques possibles, et la volonté du neurologue de protéger le cerveau de son patient le mieux et le plus longtemps possible.
Un message positif est qu’actuellement nous disposons de suffisamment de molécules pour pouvoir changer de traitement et trouver celui qui convient le mieux à chaque patient, sans courir des risques démesurés d’accélération de la maladie.
Quels sont les traitements pour les formes progressives de la maladie ?
Pour les formes secondaires progressives de la maladie, nous avons maintenant des études sur le long terme (au moins 15 ans) montrant qu’un traitement de première ligne des formes rémittentes repousse significativement l’entrée dans la phase secondaire progressive et peut même éviter celle-ci. Nous savons aussi que le nombre total de lésions détectées en IRM après 5 ans d’évolution de la maladie est un bon facteur prédictif de survenue d’une phase progressive secondaire. Si la charge lésionnelle devient importante et sévère durant les 5 premières années de la maladie, le risque d’une forme progressive est beaucoup plus grand que si la charge lésionnelle reste faible ou moyenne. Or, c’est le but des traitements de première ligne d’empêcher l’accumulation des lésions et de limiter cette charge lésionnelle totale. D’autres études ont montré qu’il n’y a pas intérêt à arrêter les traitements de première ligne chez les personnes qui commenceraient d’entrer en phase secondaire progressive car elles évolueront moins vite et resteront mieux à l’abri de nouvelles poussées surajoutées.
Le Tysabri a été étudié dans les formes secondaires progressives et ne s’est pas révélé efficace en fonction de l’objectif prédéterminé, à savoir la proportion de patients avec aggravation de l’échelle EDSS en 6 mois.
Le seul résultat positif de cette étude a été montré sur un objectif secondaire, à savoir le maintien d’une meilleure dextérité des mains.
Par contre, une étude avec un analogue du Gilenya appelé Siponimod s’est révélée positive en ralentissant la progression du handicap de 25 % environ.
Dans les formes primaires progressives, le Gilenya a été testé lors d’une étude de phase 3, avec comme objectif primaire de diminuer la proportion de patients en aggravation sur un intervalle de 3 mois. Cette étude a échoué car il n’y avait pas de différence entre les personnes recevant le médicament et celles recevant le placebo.
Par contre, l’Ocrélizumab (Ocrévus) a montré une efficacité relative de 24% en ralentissant la vitesse de progression du handicap sur 3 mois. Ces résultats sont significatifs mais restent modestes. Ils sont meilleurs chez des personnes relativement jeunes, ayant moins de 55 ans, et ayant des signes d’une maladie progressive active.
D’autres essais cliniques sont en cours en phase 3. Ils concernent, par exemple, la simvastatine (un anti- cholestérol), la biotine, et l’ibudilast. Ils ont tous les trois montré des résultats positifs dans des études cliniques de phase 2, mais l’interprétation des résultats et les méthodologies ne font pas toujours l’unanimité.
De toute façon, ces résultats doivent être confirmés ou infirmés dans des études de phase 3.
Par exemple, l’essai clinique de l’ibudilast pris par voie orale vient d’être publié (30/08/2018) et concernait 255 patients (une moitié avec forme secondaire progressive et une moitié avec forme primaire progressive). L’atrophie cérébrale était réduite de 50 % environ chez les patients recevant le produit actif par rapport au groupe placebo.
Il s’agit donc de molécules qui n’ont pas d’action directe sur le système immunitaire mais pourraient favoriser la neuroprotection des fibres nerveuses et lutter contre leur dégénérescence secondaire.
Ce sont de nouvelles approches pour les formes progressives et les premiers résultats sont encourageants, ce qui contraste avec les résultats toujours négatifs observés avant 2016.
Qu'est-ce que la thérapie cellulaire? Est-ce prometteur pour l'avenir?
Le mode d’action des médicaments immunomodulateurs décrits précédemment est globalement peu spécifique et induit des modifications très globales du système immunitaire, à l’unique exception de la Copaxone.
Ceci est dû au fait que nous ne connaissons pas encore précisément les anomalies immunitaires qui provoquent spécifiquement la SEP.
La thérapie cellulaire se propose d’avoir une action très sélective et très spécifique pour chaque maladie auto-immune en essayant de corriger la phase toute initiale du dérèglement et de la dérégulation du système immunitaire.
L’idée de base est d’isoler des cellules particulières circulant dans le sang, de les cultiver en laboratoire, et de les éduquer à devenir tolérantes aux auto- antigènes potentiels spécifiques d’un type particulier de maladies auto-immunes (voir définition ci-dessous).
Ensuite ces cellules doivent être réinjectées dans le sang des patients dont elles proviennent, en espérant ainsi régulariser le fonctionnement de leur système immunitaire personnel.
Il s’agit donc d’études encore très débutantes, fortement liées à la recherche fondamentale en immunologie, qui doivent faire leurs preuves d’efficacité et d’innocuité pour l’organisme sur le plan conceptuel.
La recherche: quelles sont les perspectives d'avenir?
Il n’y a pas UNE recherche en SEP, il y a de nombreux sujets de recherche à propos de cette maladie qui relèvent à la fois de l’immunologie, de la neurobiologie, de la neuro-imagerie, de la neuropharmacologie, des maladies inflammatoires et des maladies neurodégénératives.
Par ailleurs, la recherche dépend des moyens technologiques à notre disposition et des progrès de ces technologies. On peut, dès lors, essayer de distinguer différentes thématiques.
Les recherches à orientation immunologique :
Elles essaient de déterminer les mécanismes du dérèglement du système immunitaire dans la SEP. Elles se concentrent sur les lymphocytes régulateurs de la réaction immunitaire, sur les cellules présentatrices des antigènes aux lymphocytes, sur la caractérisation moléculaire des possibles auto-antigènes spécifiques de la SEP, sur la possibilité de réactions croisées avec des agents extérieurs, sur la manière dont le cerveau est colonisé par les cellules inflammatoires et la possibilité d’éradiquer ces cellules retranchées derrière la barrière hémato-encéphalique.
Les études de génétique :
Les études de génétique à la recherche de nouveaux gènes de susceptibilité, des interactions entre les gènes protecteurs et les gènes favorisant l’éclosion de la maladie, l’interaction entre l’expression des gènes et des facteurs de l’environnement, la régulation de l’expression des gènes responsables des réactions immunitaires déréglées. Ces études nécessitent la manipulation mathématique et statistique d’un nombre immense de données ("big data") et donc de moyens statistiques et informatiques les plus sophistiqués.
Les recherches cliniques :
Elles gardent toute leur importance. La description de l’évolution de la maladie au long cours, la description des effets des traitements actuels après 20 ou 25 ans, la description d’effets secondaires inhabituels, l’épidémiologie de la maladie, son augmentation en prévalence et en incidence, la découverte de nouveaux facteurs de risque dans l’environnement, les interactions avec le vieillissement des personnes, l’apport des techniques kinésithérapiques et de rééducation cognitive de manière rigoureuse... sont autant de sujets pour les neurologues cliniciens.
L’amélioration des techniques d’imagerie cérébrale :
pour mieux mesurer non seulement la réaction inflammatoire, mais la dégénérescence secondaire des faisceaux nerveux, l’éventuelle remyélinisation, la stabilisation des processus d’atrophie cérébrale, la détection de micro-lésions de la barrière hémato- encéphalique et de micro-foyers inflammatoires persistants.
L’étude des mécanismes de neurodégénérescence et de mort neuronale :
L’étude des mécanismes de neurodégénérescence et de mort neuronalesecondaires à l’inflammation et à la transsection des fibres nerveuses. Ces études doivent se faire le plus souvent dans des modèles expérimentaux sur des rongeurs (souris ou rat).
L’étude des phénomènes de remyélinisation :
L’étude des phénomènes de remyélinisation et des facteurs pouvant inhiber celle-ci. Stimuler la production d’oligodendrocytes matures, protéger la fibre nerveuse pour qu’elle puisse être remyélinisée, découvrir des facteurs stimulant cette reconstruction cérébrale.
La recherche de marqueurs d’inflammation et de dégénérescence :
La recherche de marqueurs d’inflammation et de dégénérescence utilisables en routine clinique à partir de prélèvements de sang. Le dosage d’une protéine particulière des fibres nerveuses appelées protéine légère des neurofilaments (NFL) devient possible dans des échantillons sanguins et permettra de mesurer la gravité d’une poussée, l’importance des lésions des fibres nerveuses, la persistance d’une destruction axonale à bas bruit. Ce dosage pourra sans doute être disponible de manière généralisée dans les 2 ou 3 ans qui viennent et sera certainement très utile pour déterminer le degré d’activité de la maladie et déterminer l’efficacité d’un traitement (un traitement efficace devrait normaliser les taux de NFL dans le sang).
D’autres marqueurs immunitaires sont certainement nécessaires pour différencier les formes d’évolution agressive par rapport aux formes d’évolution modérée ou très lente afin de mieux adapter le traitement à chaque patient individuel.
Les études pharmacologiques :
Les études pharmacologiques pour la mise au point de nouveaux médicaments neuroprotecteurs et favorisant la reconstruction de la myéline, pour améliorer l’efficacité et la spécificité des médicaments actuels, pour en diminuer les effets secondaires, pour en améliorer la facilité et le confort d’administration, et pour faciliter la pénétration de ces molécules dans le cerveau.
Qu'est-ce que le registre BELTRIMS?
Ce registre a été initié par le Groupe belge d’études de la sclérose en plaques. Il est informatisé sur un site Internet sécurisé. Avec l’accord du patient, le neurologue traitant peut y introduire les données démographiques, les données de base concernant la maladie, et surtout le type de traitement pris par le patient, la survenue de poussées ou d’une progression malgré le traitement, la présence d’effets secondaires, la survenue de grossesses, et d’éventuels changements de traitement pour intolérance ou inefficacité. Ce registre devrait permettre une comparaison indirecte des nouveaux médicaments entre eux, en déterminant la fréquence des échecs thérapeutiques, des intolérances, et la réduction des poussées.
Le registre dépend de l’action bénévole des neurologues traitants, est indépendant des firmes pharmaceutiques et ne reçoit malheureusement pas de subsides des Pouvoirs Publics, contrairement à d’autres registres particulièrement dans les pays scandinaves. Ces derniers ont montré tout leur intérêt scientifique en permettant des études sur un grand nombre de personnes à l’échelle d’un pays, en déterminant ainsi la survenue d’effets secondaires inattendus, en apportant des données épidémiologiques concernant par exemple le tabagisme. De manière générale, les outils statistiques font cruellement défaut en Belgique.
Quel message les chercheurs et les médecins pourraient-ils transmettre aux personnes atteintes de SEP?
Le premier message est celui d’un optimisme raisonné. Durant ces 20 dernières années, les progrès dans notre connaissance de la maladie et les progrès thérapeutiques ont été remarquables, et il est certain que ces progrès se poursuivront durant les 20 prochaines années. Cette évolution positive a été réalisée malgré la complexité extrême de la maladie dont il a fallu révéler, petit à petit, les pièces du puzzle. Le travail n’est certainement pas terminé mais les perspectives sont de mieux en mieux définies et un nombre de plus en plus important de chercheurs et de neurologues s’intéressent à la maladie et y investissent leur temps et leur énergie.
Un message plus spécifiquement adressé aux personnes atteintes de SEP est de ne pas baisser les bras. Le conseil est d’être suivi régulièrement par un neurologue traitant (auquel on sera lié par un "contrat de confiance"), de poursuivre une kinésithérapie d’entretien, de rechercher les meilleurs traitements symptomatiques, même si nous savons que nos moyens thérapeutiques restent limités pour les formes de la maladie ayant évolué depuis de nombreuses années et pour les formes progressives de celle-ci.
Un autre message est d’essayer de rester dans le rationnel et non dans l’émotionnel lorsque l’on parle de nouveaux traitements, de nouvelles possibilités thérapeutiques...
Notre médecine doit rester basée sur l’objectivité de la démarche scientifique et cette dernière nécessite d’examiner de manière critique toutes les "nouveautés" et d’exiger qu’elles soient confirmées par d’autres chercheurs indépendants ou par une 2ème étude menée indépendamment sur un groupe différent de patients. L’emballement souvent médiatique pour des techniques simplistes ne peut être que source de déception.
Lexique
Lésion focale :
Lésion bien localisée avec des limites nettes. C’est le cas pour la majorité des plaques de SEP
Auto antigènes :
On appelle antigène toute substance étrangère à l'organisme capable de déclencher une réponse immunitaire visant à l'éliminer.
Il s'agit le plus souvent de protéines ou de peptides (fragments de protéines) qui sont reconnus de manière spécifique par des anticorps et également par certains globules blancs, les lymphocytes T8. Les anticorps sont produits par les lymphocytes B et leur production est stimulée par les lymphocytes T4 qui jouent un rôle de chef d'orchestre du système immunitaire.
Les auto antigènes sont donc des antigènes suscitant, dans un organisme dont ils font partie, la formation d'anticorps réagissant contre eux. Cette possibilité démontre un dysfonctionnement du système immunitaire.
Polyarthrite rhumatoïde
C'est une maladie dégénérative inflammatoire chronique, caractérisée par une atteinte articulaire, évoluant par poussées vers la déformation et la destruction des articulations atteintes.
Lupus érythémateux
Le lupus est une maladie chronique auto-immune, qui survient lorsque le système immunitaire s’attaque aux cellules de l’organisme et les détruit. Il peut toucher de nombreuses parties du corps, dont les articulations, la peau, les reins, le coeur, etc.
Psoriasis
Le psoriasis est une maladie inflammatoire de la peau. Il se caractérise généralement par l'apparition d'épaisses plaques de peau qui desquament (qui se détachent sous formes "d’écailles" blanches).
Maladie de Crohn
La maladie de Crohn est une maladie inflammatoire chronique intestinale (MICI) qui peut atteindre tout le tube digestif et éventuellement la peau, les articulations et les yeux.
Athérosclérose
L’athérosclérose constitue la forme la plus fréquente d’artériosclérose, une sclérose au niveau des artères. En d’autres termes, elle constitue un problème caractérisé par un durcissement et une perte d’élasticité de la paroi des artères. L’athérosclérose est due au développement d’une plaque d’athérome. Cette plaque se forme et se développe progressivement par dépôts successifs de lipides (graisses).
Hémoglobine
C’est la protéine principale des globules rouges. Son analyse et sa quantification par des tests sanguins peuvent être utiles pour mesurer un état d'anémie.
Notes et références
Tiré à part du journal la Clef, décembre 2018 - Ligue Belge de la Sclérose en Plaques - Communauté Française ASBL - rédigé par le Professeur Christian SINDIC Président de la Fondation Charcot